题目内容
11.铅的化合物有+2和+4两种,且低价态化合物较稳定.(1)冶炼铅时,先将方铅矿(PbS)焙烧使之变成氧化物,再用还原剂还原便得到粗铅,请写出焙烧时的化学方程式2PbS+3O2=2PbO+2SO2冶炼2.39t方铅矿(假设不含杂质)至少消耗3.36m3(标准状况)O2.
(2)水溶液中铅存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)${\;}_{3}^{-}$、Pb(OH)${\;}_{4}^{2-}$,个形态的浓度分数a随溶液pH变化的关系如图所示
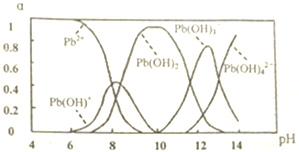
向Pb(NO3)2溶液中滴加NaOH溶液,当pH由13上升到14时,主要发生反应的离子方程式为Pb(OH)3-+OH-=Pb(OH)4-
(3)称取含有PbO和Pb02的混合试样1.115 g,在酸性溶液中用25.00 mL0.2000 mol.L-1H2C204溶液 处理,使Pb02还原为Pb2+.将溶液中和后,使Pb2+全部沉淀为PbC204.过滤,将滤液酸化,以0.0500 mol.L-1KMn04溶液滴定,用去8.00mL.沉淀用酸溶解后,用相同浓度KMn04溶液滴定至终点,消耗24.00mL.计算试样中PbO的质量分数40%.
分析 (1)根据题意:方铅矿(PbS)焙烧使之变成氧化物,即得到氧化铅PbO,据此书写方程式,并根据化学方程式进行计算即可;
(2)向Pb(NO3)2溶液中滴加NaOH溶液,当pH由13上升到14时,根据图是信息,得到此时离子的存在形式为:Pb(OH)4-;
(3)根据方程式:Pb02+2C2042-+4H+=PbC204+2C02+2H20,Pb2++C2042-=PbC204↓来计算.
解答 解:(1)根据题意:方铅矿(PbS)焙烧使之变成氧化物,即得到氧化铅PbO,据此书写方程式为:2PbS+3O2=2PbO+2SO2,根据化学方程式,冶炼2.39t方铅矿(假设不含杂质)消耗氧气的物质的量是:$\frac{2.39×1{0}^{6}g×3}{2×239}$=150mol,体积是:150mol×22.4L/mol=3360L=3.36m3,故答案为:2PbS+3O2=2PbO+2SO2;3.36;
(2)向Pb(NO3)2溶液中滴加NaOH溶液,当pH由13上升到14时,根据图是信息,得到此时离子的存在形式为:Pb(OH)4-,发生反应为:Pb(OH)3-+OH-=Pb(OH)4-,故答案为:Pb(OH)3-+OH-=Pb(OH)4-;
(3)设:n(Pb02)=xmol,n(Pb0)=ymol,根据反应:Pb02+2C2042-+4H+=PbC204+2C02+2H20,Pb2++C2042-=PbC204↓,还原二氧化铅以及沉淀所有的Pb2消耗草酸的量为:①2x+y=0.025L×0.2000mol/L-$\frac{5}{2}$×0.0500 mol.L-1×0.008L=0.004mol,沉淀所有的Pb2消耗草酸的量为②x+y=$\frac{5}{2}$×0.0500 mol.L-1×0.024L=0.003mol,①②联立得到x=0.001mol,y=0.002mol,所以试样中PbO的质量分数$\frac{0.002mol×223g/mol}{1.115g}$×100%=40%,故答案为:40%.
点评 本题涉及氧化还原反应方程式的书写和计算、关于滴定法测定物质的含量等知识,注意知识的综合应用是解题的关键,难度中等.

 特高级教师点拨系列答案
特高级教师点拨系列答案| A. | CH≡CH+H2O$→_{△}^{HgSO_{4}}$CH3CHO | |
| B. | C2H5Br+H2O$→_{△}^{NaOH}$C2H5OH+HBr | |
| C. |  +HONO2$→_{△}^{浓硫酸}$ +HONO2$→_{△}^{浓硫酸}$ +H2O +H2O | |
| D. | CH3COOCH3+H2O$?_{△}^{催化剂}$CH3COOH+CH3OH |
| A. | 塑料 | B. | 高炉炼铁 | C. | 普通玻璃 | D. | 生石灰 |
| A. | Ba2+、Mg2+、SO42-、Cl- | B. | NH4+、Na+、Cl-、OH- | ||
| C. | K+、Na+、SO42-、NO3- | D. | H+、Cl-、HCO3-、SO42- |
| A. | 镁、铝的熔点很高,可用于制耐火坩埚 | |
| B. | 小苏打受热分解生成气体,可用作发酵粉 | |
| C. | 铁的活泼性较强,铁粉可用作食品袋内的脱氧剂 | |
| D. | Na、Cu等金属化合物焰色反应呈现各种艳丽色彩,可制成节日烟花 |
| A. | Al Cr2O3 | B. | Al2O3 Fe | C. | Al MgO | D. | Al CO2 |
| A. | 铁和氯化铁溶液反应:Fe3++Fe═2Fe2+ | |
| B. | 醋酸和氢氧化钠溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| C. | 实验室用MnO2和浓盐酸制取Cl2:MnO2+2H++2Cl-═Mn2++Cl2↑+H2O | |
| D. | 氢氧化铁和盐酸反应:H++OH-═H2O |
 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题: