题目内容
16.下列说法不正确的是( )| A. | ⅠA族元素的金属性一定比ⅡA族元素的金属性强 | |
| B. | ⅥA族元素中氢化物最稳定的其沸点一定最高 | |
| C. | 非金属元素形成的化合物中也可能是离子化合物 | |
| D. | 离子化合物中可能含有共价键 |
分析 A、根据金属性的递变规律判断;
B、根据ⅥA族元素中O元素的非金属性分析;
C、根据铵盐的组成元素都是非金属元素判断;
D、氢氧化钠中含有共价键的离子化合物.
解答 解:A、同一周期从左到右元素的金属性逐渐减弱,同一主族从上到下元素的金属性逐渐增强,第ⅠA族中的H元素的金属性较弱,小于第ⅡA族中的Mg元素的金属性,故A错误;
B、ⅥA族元素中O元素的非金属性最强,氢化物最稳定,含有氢键,沸点最高,故B正确;
C、铵盐的组成元素都是非金属元素,为离子化合物,含有离子键,故C正确;
D、氢氧化钠中含有共价键的离子化合物,所以离子化合物中可能含有共价键,故D正确;
故选A.
点评 本题考查元素周期律知识,题目难度不大,本题易错点为D,注意离子化合物中可能含有共价键.

练习册系列答案
相关题目
7.下列图示实验装置正确的是( )
| A. |  制乙烯 | B. |  测量SO2的体积 | C. |  铁丝燃烧 | D. |  喷泉实验 |
4.在无色透明溶液中,不能大量共存的离子组是( )
| A. | Cu2+、Na+、SO42-、Ba2+ | B. | K+、Na+、HCO3-、NO3- | ||
| C. | OH-、HCO3-、Ca2+、Na+ | D. | Ba2+、Na+、OH-、NO3- |
1.高铁电池是一种新型电池,与普通高能电池相比,该电池长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O═3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
| A. | 放电时正极附近溶液的碱性增强 | |
| B. | 放电时每转移3mol电子,正极有1mol K2FeO4被氧化 | |
| C. | 放电时正极反应为:Zn-2e-+2OH-═Zn(OH)2 | |
| D. | 该原电池,Zn作正极,可用石墨等作负极 |
5.苯与浓硫酸反应生成苯磺酸和水: +HO-SO3H$\stackrel{70℃~80℃}{→}$
+HO-SO3H$\stackrel{70℃~80℃}{→}$ +H2O,该反应属于( )
+H2O,该反应属于( )
 +HO-SO3H$\stackrel{70℃~80℃}{→}$
+HO-SO3H$\stackrel{70℃~80℃}{→}$ +H2O,该反应属于( )
+H2O,该反应属于( )| A. | 置换反应 | B. | 中和反应 | C. | 复分解反应 | D. | 取代反应 |
6.下列除杂方案正确的是( )
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | CO2(g) | SO2(g) | 饱和NaHSO3溶液,浓H2SO4 | 洗气 |
| B | 乙酸乙酯 | 乙酸 | 过量的饱和碳酸钠溶液 | 分液 |
| C | Na2CO3(s) | NaHCO3(s) | 无需添加 | 灼烧 |
| D | 甲烷 | 乙烯 | 酸性KMnO4,浓H2SO4 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |

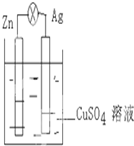 如图,在银锌原电池中,以硫酸铜溶液为电解质溶液.
如图,在银锌原电池中,以硫酸铜溶液为电解质溶液.