题目内容
工业上用含有铝、铁、铜的废弃合金为主要原料制取硫酸铝溶液、硝酸铜晶体和无水氯化铁,其生产流程如下图所示。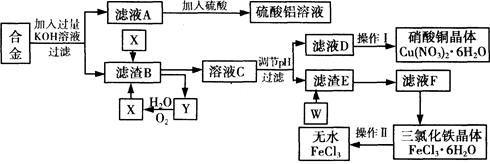
已知:调节适当PH范围可使Fe3+沉淀完全而Cu2+不会沉淀。
请回答下列问题:
(1)写出向合金中加入KOH溶液后所发生反应的离子方程式: 。
(2)在滤液A中直接加入硫酸后所得到的硫酸铝溶液中除含少量硫酸外,还一定含有的杂质是
(填化学式)。
请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液,仿照上图形式画出制备流程图(提示:在箭头上下方标出所用试剂和实验操作) 。
(3) 写出试剂X的名称 。
(4) 实验操作I的顺序依次为 (选填序号)。
| A.蒸馏 | B.蒸发浓缩 | C.过滤 | D.冷却结晶 |
(6)写出滤渣E与W反应的化学方程式: 。
(1)2Al+2OH—+2H2O=2AlO2—+3H2↑ (2)K2SO4 (合理即给分)
(合理即给分)
(3)稀硝酸 (4)BDC (5)重结晶
(6)Fe(OH)3+3HCl=FeCl3+3H2O
解析试题分析: 金属铝可以与氢氧化钾、水反应生成偏铝酸钾和氢气,过量的氢氧化钾会与硫酸反应生成硫酸钾,所以滤液A中肯定还含有硫酸钾,由于偏铝酸根离子在弱酸的条件下可生成沉淀氢氧化铝,所以由滤液A制备纯净的硫酸铝溶液流程为 ,稀硝酸能溶解铜和铁,因此X为稀硝酸,。操作I是溶液变成了结晶体,因此操作I的顺序依次为蒸发浓缩、冷却结晶、过滤。要制得更纯的Cu(NO3)2·6H2O晶体,必须进行的操作是重结晶。滤渣E为Fe(OH)3,滤渣E与W反应Fe(OH)3+3HCl=FeCl3+3H2O
,稀硝酸能溶解铜和铁,因此X为稀硝酸,。操作I是溶液变成了结晶体,因此操作I的顺序依次为蒸发浓缩、冷却结晶、过滤。要制得更纯的Cu(NO3)2·6H2O晶体,必须进行的操作是重结晶。滤渣E为Fe(OH)3,滤渣E与W反应Fe(OH)3+3HCl=FeCl3+3H2O
考点:考查化学实验物质制备的相关知识点。

通过对金属钠与水反应现象的观察,不能分析得出的结论是( )
| A.金属钠熔点低 | B.金属钠导电性强 |
| C.金属钠密度小 | D.金属钠化学性质活泼[来源 |
碳酸钠(Na2CO3)俗称纯碱,是一种重要的基础化工原料,广泛应用于玻璃、造纸等工业。下列与碳酸钠有关的说法正确的是:
| A.Na2CO3的稳定性介于Na2CO3·10H2O和NaHCO3之间 |
| B.“侯氏制碱法”制得的碱是指NaHCO3 |
| C.可用盐酸鉴别Na2CO3和NaHCO3固体 |
| D.纯碱有时可代替烧碱使用,比如溶解石英、促进乙酸乙酯的水解等 |
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
| A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂 |
| B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 |
| C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 |
| D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大 |
NaCl是一种化工原料,可以制备一系列物质(如图所示)。下列说法正确的是( )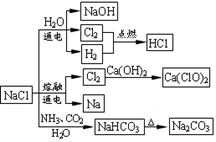
| A.石灰乳与Cl2的反应中Cl2既是氧化剂,又是还原剂 |
| B.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| C.常温下干燥Cl2能用钢瓶贮运,所以Cl2与铁不反应 |
| D.图中所示转化反应都是氧化还原反应 |
(12分)某研究性学习小组为了测定某品牌合金中铝的含量,现设计了如下实验: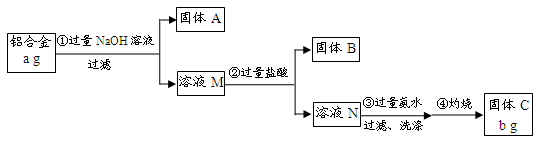
已知:(1)该铝合金的主要成分为铝、镁、铜、硅。
(2)常温下,硅能和NaOH发生反应:Si+2NaOH+H2O===Na2SiO3+2H2↑。
请回答下列问题:
(1)固体A的成分是 ;
(2)生成固体B的离子方程式为 ;
步骤③中生成沉淀的离子方程式为 ;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为
;
(4)该样品中铝的质量分数是 ;(用a、b表示)
(5)下列因操作不当,会使测定结果偏大的是 ;
| A.第①步中加入NaOH溶液不足 | B.第②步中加入盐酸不足时 |
| C.第③步中沉淀未用蒸馏水洗涤 | D.第④步对沉淀灼烧不充分 |
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的
(填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”);XY2由固态变为气态所需克服的微粒间作用力是 。氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是 ;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 。
(4)在25℃、101kPa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是 。