题目内容
(6分)中学化学常见的物质A、B、C、D、E、X有如图所示转化关系。已知A、D是单质,B为氧化物,反应①在高温下发生。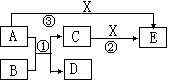
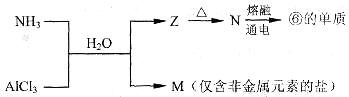
(1)若A、D、X为非金属单质,E是常见的温室气体,则A为____________,X为___________(用化学式填空)。
(2)若A为金属单质,D为非金属单质,X为盐酸,则反应①的化学方程式为________________;反应②的离子方程式________________________________。
(1)C(1分),O2(1分)
⑵①3Fe+4H2O(g)高温Fe3O4+4H2 (2分,无条件-1分)
②Fe3O4+8H+==Fe2++2Fe3++4H2O(2分)
解析试题分析:题目中信息提示:A与B反应生成C和D,这一反应是典型的置换反应,在(1)中,高温下非金属置换非金属的反应典型的为:C+H2O=CO+H2 (2)中高温下金属置换非金属的反应典型的为3Fe+4H2O(g) ="=" Fe3O4+4H2
考点:本题是以元素化合物知识为基础的无机框图推断,重点考查了置换反应的类型。

一些不法商人在面粉生产中添加过氧化钙(CaO2)等添加剂对食品进行增白。下列关于过氧化钙(CaO2)的叙述正确的是
| A.CaO2中阴、阳离子的个数比为1:1 |
| B.CaO2对面粉增白原理与SO2漂白原理相似 |
| C.CaO2和水反应时,每产生1 molO2转移电子4 mol |
| D.CaO2放入NaHCO3溶液中,会放出二氧化碳,并产生白色浑浊 |
工业上用含有铝、铁、铜的废弃合金为主要原料制取硫酸铝溶液、硝酸铜晶体和无水氯化铁,其生产流程如下图所示。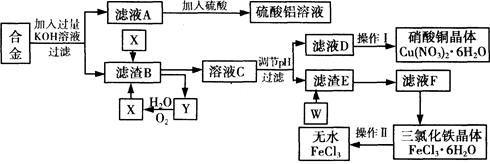
已知:调节适当PH范围可使Fe3+沉淀完全而Cu2+不会沉淀。
请回答下列问题:
(1)写出向合金中加入KOH溶液后所发生反应的离子方程式: 。
(2)在滤液A中直接加入硫酸后所得到的硫酸铝溶液中除含少量硫酸外,还一定含有的杂质是
(填化学式)。
请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液,仿照上图形式画出制备流程图(提示:在箭头上下方标出所用试剂和实验操作) 。
(3) 写出试剂X的名称 。
(4) 实验操作I的顺序依次为 (选填序号)。
| A.蒸馏 | B.蒸发浓缩 | C.过滤 | D.冷却结晶 |
(6)写出滤渣E与W反应的化学方程式: 。
(10分)信息时代产生的大量电子垃圾对环境构成严重威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含Cu、Fe及少量Au、Pt等金属的混合物,并用如下流程制备胆矾晶体(CuSO4?5H2O):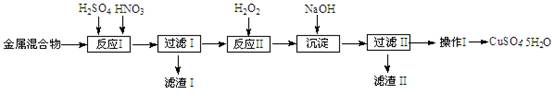
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀 | 1.5 | 6.4 | 4.2 |
| 完全沉淀 | 3.2 | 8.9 | 6.7 |
(2)反应Ⅱ中加入H2O2的作用是______。
(3)沉淀过程中发生反应的离子方程式有______、______。
(4)操作Ⅰ的步骤是______、______、过滤、洗涤、干燥。
(5)测定胆矾晶体纯度的实验步骤如下:
a. 准确称取3.125g胆矾晶体样品配成100mL溶液;
b. 取10.00 mL溶液于带塞锥形瓶中,加适量水稀释,加入过量KI固体,发生反应:
2Cu2+ +4Iˉ=2CuI↓ + I2
c. 继续向上述混合物中,逐滴加入0.1000 mol·L-1Na2S2O3溶液至恰好完全反应,共消耗12. 00mL Na2S2O3溶液:I2+2S2O
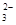 = 2Iˉ+S4O
= 2Iˉ+S4O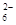
求样品中胆矾晶体的质量分数(写出计算过程)。