题目内容
 (1)在一定条件下,在水溶液中 1molCl-、ClOx-(x=1,2,3,4)的能量(kJ)的相对大小如图所示.
(1)在一定条件下,在水溶液中 1molCl-、ClOx-(x=1,2,3,4)的能量(kJ)的相对大小如图所示.①D是
②B→A+C反应的热化学方程式为:
(2)已知:C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
CO(g)+
| 1 |
| 2 |
则1mol C(s)与O2(g)反应生成CO(g)的△H=
考点:热化学方程式,反应热和焓变
专题:化学反应中的能量变化
分析:(1)一定条件下,在水溶液1 mol Cl-、ClOx-(x=1,2,3,4,)的能量(kJ)相对大小如图所示.
①D中Cl元素化合价为+7价,据此判断x值;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式.
①D中Cl元素化合价为+7价,据此判断x值;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式.
解答:
解:(1)①根据图象知,D中Cl元素化合价为+7价,所以ClOx-中x为4,则D为ClO4-,故答案为:ClO4-;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,所以该热化学反应方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol,
故答案为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol;
(2)①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO(g)+
O2(g)═CO2(g)△H2=-283kJ/mol.
依据盖斯定律①-②得到:C(s)+
O2(g)═CO(g)△H=-110.5KJ/mol;
故答案为:-110.5 kJ/mol.
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,所以该热化学反应方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol,
故答案为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol;
(2)①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO(g)+
| 1 |
| 2 |
依据盖斯定律①-②得到:C(s)+
| 1 |
| 2 |
故答案为:-110.5 kJ/mol.
点评:本题考查反应热的有关计算,注意掌握根据盖斯定律、热化学方程式进行的计算,题目较简单.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
下列实验方案不能达到实验目的是( )
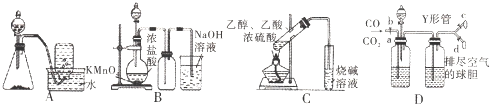

| A、图A装置用Cu和浓硝酸可制取NO |
| B、图B装置可用于实验室制备Cl2 |
| C、图C装置可用于实验室制取乙酸乙酯 |
| D、图D装置可用于实验室分离CO和CO2 |
一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)?2HI(g),已知H2和I2的起始浓度均为0.1mol?L-1时,达平衡时HI浓度为0.16mol?L-1.若H2和I2的起始浓度均变为0.2mol?L-1,则平衡时H2的浓度(mol?L-1)是( )
| A、0.16 | B、0.08 |
| C、0.04 | D、0.02 |
下列实验操作中不正确的是( )
| A、用容量瓶配制一定物质的量浓度的NaOH溶液时,溶解后的溶液要马上转移至容量瓶 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、蒸发结晶时当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干 |
| D、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
下列各离子组可在同一无色溶液中大量共存的是( )
| A、Na+、Mg2+.、OH-、Cl- |
| B、Cu2+、Ba2+、NO3-、SO42- |
| C、Na+、Mg2+、CO32-、SO42- |
| D、H+、K+、Cl-、NO3- |
水泥工业和玻璃制造业都需要的一种原料是( )
| A、二氧化硅 | B、碳酸钙 |
| C、氢氧化钙 | D、浓硫酸 |
下列事实中,不能用勒夏特列原理解释的是( )
| A、向蓝色的CoCl2盐酸溶液中加少量水,溶液变紫色 |
| B、工业合成氨常采用较高压强(20MPa~30 MPa)下进行,以提高原料利用率 |
| C、由H2(g)、I2(g)、HI(g)组成的平衡体系,压缩容器体积后颜色加深 |
| D、工业上生产硫酸的过程中使用适当过量的空气以提高二氧化硫的利用率 |
下列物质中属于强电解质的是( )
| A、二氧化硅 | B、碳酸钙 |
| C、氢氧化铜 | D、浓硫酸 |