题目内容
17.氮有不同价态的氧化物,如NO、N2O3、NO2、N2O5等,它们在一定条件下可以相互转化.(1)己知:2NO(g)+O2(g)═2NO2(g)△H1=-113kJ•mol-1
NO(g)+O3(g)═NO2(g)+O2(g)△H2=-199kJ•mol-1
4NO2(g)+O2(g)═2N2O5(g)△H4=-57kJ•mol-1
则反应6NO2 (g)+O3(g)═3N2O5(g)△H=-228kJ•mol-1.
(2)某温度下,在一体积可变的密闭容器中充入1mol N2O3,发生反应N2O3(g)?NO2(g)+NO(g)
达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图象如图1所示,有关说法正确的是C
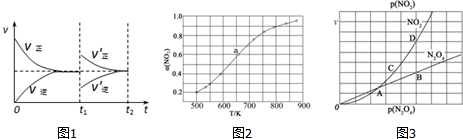
A.t1时刻改变的条件是增大N2O3的浓度,同时减小NO2或NO的浓度
B.t1时刻改变条件后,平衡向正反应方向移动,N2O3的转化率增大
C.在t2时刻达到新的平衡后,NO2的百分含量不变
D.若t1时刻将容器的体积缩小至原容器的一半,则速率~时间图象与上图相同
(3)在1000K下,在某恒容容器中发生下列反应:2NO2(g)?2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图2所示.图中a点对应温度下,已知NO2的起始压强p0为120kPa,列式计算该温度下反应的平衡常数Kp=81(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(4)对于反应N2O4(g)?2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1•p(N2O4),v(NO2)=k2•p2(NO2).其中,kl、k2是与反应及温度有关的常数.相应的速率~压强关系如图3所示.一定温度下,kl、k2与平衡常数Kp的关系是kl=$\frac{1}{2}$K2•Kp,在如图标出的点中,指出能表示反应达到平衡状态的点B点与D点,理由是满足平衡条件υ(NO2)=2υ(N2O4)..
分析 (1)①2NO(g)+O2(g)═2NO2(g)△H1=-113kJ•mol-1
②NO(g)+O3(g)═NO2(g)+O2(g)△H2=-199kJ•mol-1
③4NO2(g)+O2(g)═2N2O5(g)△H4=-57kJ•mol-1
将方程式②+③×$\frac{3}{2}$-①×$\frac{1}{2}$得6NO2 (g)+O3(g)═3N2O5(g),据此计算焓变;
(2)根据速率与时间的变化图象可知,t1时刻改变某一条件后,反应N2O3(g)?NO2(g)+NO(g)正反应速率增大,逆反应速率减小,又该反应为体积可变的容器,所以根据图象中最后达到平衡的速率和之前速率相同,可知应该是恒压条件下充入反应物,据此分析判断;
(3)图中a点对应温度下,NO2的转化率是0.6,设原来NO2的物质的量为xmol,转化的物质的量为0.6xmol,
2NO2(g)?2NO(g)+O2(g),
开始 x 0 0
转化0.6xmol 0.6xmol 0.3xmol
平衡0.4xmol 0.6xmol 0.3xmol
则混合气体的物质的量=0.4xmol+0.6xmol+0.3xmol=1.3xmol,相同条件下,气体的压强之比等于其物质的量之比,所以反应后压强=$\frac{120kPa}{xmol}$×1.3xmol=156KPa,NO2的分压=156KPa×$\frac{0.4xmol}{1.3xmol}$=48KPa,
NO的分压=156KPa×$\frac{0.6xmol}{1.3xmol}$=72KPa,
O2的分压=156KPa×$\frac{0.3xmol}{1.3xmol}$=36KPa
根据该温度下反应的平衡常数Kp=$\frac{p(O{\;}_{2})p(NO){\;}^{2}}{p(NO{\;}_{2}){\;}^{2}}$计算;
(4)根据化学平衡常数Kp=$\frac{[p(NO{\;}_{2})]{\;}^{2}}{p(N{\;}_{2}O{\;}_{4})}$及二者的反应速率之比等于其计量数之比推断;满足平衡条件υ(NO2)=2υ(N2O4)即为平衡点.
解答 解:(1)①2NO(g)+O2(g)═2NO2(g)△H1=-113kJ•mol-1
②NO(g)+O3(g)═NO2(g)+O2(g)△H2=-199kJ•mol-1
③4NO2(g)+O2(g)═2N2O5(g)△H4=-57kJ•mol-1
将方程式②+③×$\frac{3}{2}$-①×$\frac{1}{2}$得6NO2 (g)+O3(g)═3N2O5(g),△H=-199kJ•mol-1-57kJ•mol-1×$\frac{3}{2}$+113kJ•mol-1×$\frac{1}{2}$=-228kJ•mol-1,
故答案为:-228kJ•mol-1;
(2)A.该反应为体积可变的容器,所以根据图象中最后达到平衡的速率和之前速率相同,可知改变的条件应该是恒压条件下充入反应物,故A错误;
B.改变的条件应该是恒压条件下充入反应物,等效平衡,故平衡时反应物转化率不变,故B错误;
C.改变的条件应该是恒压条件下充入反应物,等效平衡,故平衡时二氧化氮体积分数不变,故C正确;
D.若t1时刻将容器的体积缩小至原容器的一半,则压强增大,正逆反应速率都增大,所以速率~时间图象与上图不同,故D错误;
故选:C;
(3)图中a点对应温度下,NO2的转化率是0.6,设原来NO2的物质的量为xmol,转化的物质的量为0.6xmol,
2NO2(g)?2NO(g)+O2(g),
开始 x 0 0
转化0.6xmol 0.6xmol 0.3xmol
平衡0.4xmol 0.6xmol 0.3xmol
则混合气体的物质的量=0.4xmol+0.6xmol+0.3xmol=1.3xmol,相同条件下,气体的压强之比等于其物质的量之比,所以反应后压强=$\frac{120kPa}{xmol}$×1.3xmol=156KPa,NO2的分压=156KPa×$\frac{0.4xmol}{1.3xmol}$=48KPa,
NO的分压=156KPa×$\frac{0.6xmol}{1.3xmol}$=72KPa,
O2的分压=156KPa×$\frac{0.3xmol}{1.3xmol}$=36KPa
化学平衡常数Kp=$\frac{p(O{\;}_{2})p(NO){\;}^{2}}{p(NO{\;}_{2}){\;}^{2}}$=$\frac{36×72{\;}^{2}}{48{\;}^{2}}$=81,
故答案为:81;
(4)反应N2O4(g)?2NO2(g),则化学平衡常数Kp=$\frac{[p(NO{\;}_{2})]{\;}^{2}}{p(N{\;}_{2}O{\;}_{4})}$,二者的反应速率之比等于其计量数之比,
则υ(NO2):υ(N2O4)=k2•p2(NO2):k1•p(N2O4)=2:1,又化学平衡常数Kp=$\frac{[p(NO{\;}_{2})]{\;}^{2}}{p(N{\;}_{2}O{\;}_{4})}$,
所以K1=$\frac{1}{2}$K2•Kp,
满足平衡条件υ(NO2)=2υ(N2O4)即为平衡点,B、D点的压强之比等于其反应速率之比为1:2,所以B、D为平衡点,
故答案为:$\frac{1}{2}$K2•Kp;B点与D点;满足平衡条件υ(NO2)=2υ(N2O4).
点评 本题考查化学平衡有关计算,为高频考点,涉及平衡计算、盖斯定律等知识点,侧重考查学生分析计算及获取信息解答问题能力,难点是(3)题平衡常数的计算,注意分压的计算方法,题目难度中等.

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案| A. | Cl2水,NaOH(aq) | B. | KMnO4(aq),氨水 | C. | H2O2溶液,氧化铜 | D. | HNO3(aq),氨水 |
(1)上述反应使用等质量的某种催化剂时,温度和催化剂的比表面积对化学反应速率的影响对比实验如下表,c(NO)浓度随时间(t)变化曲线如图:
| 编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | a | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | b |
②实验说明,该反应是放热反应(填“放热”或“吸热”).
③若在500℃时,投料$\frac{{c({NO})}}{{c({CO})}}=1$,NO的转化率为80%,则此温度时的平衡常数K=第一种情况:设c(NO)=1mol•L-1,则K=160,
第二种情况:设c(NO)=amol•L-1,K=$\frac{160}{a}$,
第三种情况:设n(NO)=amol,容器的容积为V L,则K=$\frac{160V}{a}$.
(2)使用电化学法也可处理NO的污染,装置如图2.已知电解池阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:2HSO3-+2H++2e-=S2O42-+2H2O.吸收池中除去NO的离子方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-.
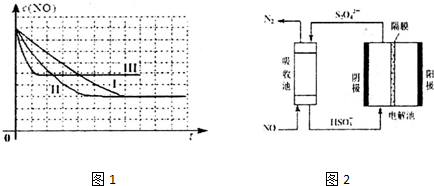
(1)海带中富含碘,请简述检验碘的实验方案取海带灼烧成灰,加水浸取后过滤,向滤液中加入硫酸与双氧水,再加淀粉试液变蓝,说明含有碘;
(2)已知反应2HI(g)═H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molHI(g)分子中化学键断裂时分别需要吸收436KJ、299KJ的能量,则1molI2(g)分子中化学键断裂时需吸收的能量为151kJ;
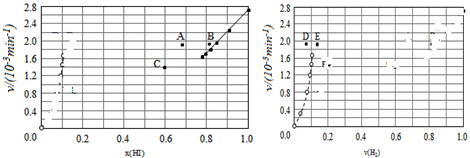
(3)Bodensteins研究了下列反应:2HI(g)═H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
②其他条件不变,向平衡后体系中再加入少量HI,则平衡向正(填“正”或“逆”)反应方向移动,达到平衡后x(HI)不变(填“增大”、“减小”或“不变”).
③上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{K}_{正}}{K}$(以K和K正表示);若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1min-1.
④由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为A、E(填字母).
| A. | 9.2g甲酸中,所含化学键的数目为0.8 NA | |
| B. | 常温下,28g Fe与足量的浓硝酸反应,转移的电子数为1.5NA | |
| C. | 标准状况下,2.24LNH3和CH4的混合气体,所含电子总数为NA | |
| D. | 标准状况下,22.4L己烷所含有的分子数目为NA |
| A. | 10mL pH=13的氨水与10mL pH=l的盐酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | l0 mL0.1 mol/L NH4Cl溶液与5mL 0.2mol/LNaOH溶液混合:c(Cl-)=c(Na+)>c(OH-)>(H+) | |
| C. | 10 mL 0.1 mol/L CH3COOH溶液与10 mL pH=13的NaOH溶液混合:c(CH3COO-)=c(Na+)>c(OH-)>c(H+) | |
| D. | l0 mL 0.5mol/L CH3COONa溶液与6mL pH=0的盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
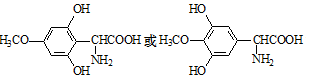 .
.