题目内容
已知Zn和Fe2O3在高温下发生反应:3Zn+Fe2O3=2Fe+3ZnO,其中Fe元素化合价 (升高或者降低) (得到或失去)电子, 被还原,发生 反应,是 剂.Zn是 剂,被 ,发生 反应.氧化产物是 还原产物是 .
考点:氧化还原反应
专题:氧化还原反应专题
分析:3Zn+Fe2O3=2Fe+3ZnO中,Zn元素的化合价由0升高为+2价,Fe元素的化合价由+3价降低为0,结合氧化还原反应基本概念来解答.
解答:
解:3Zn+Fe2O3=2Fe+3ZnO中,Fe元素的化合价由+3价降低为0,得到电子,氧化铁被还原,发生还原反应,对应的还原产物为Fe,则氧化铁为氧化剂;Zn元素的化合价由0升高为+2价,Zn为还原剂,失去电子,被氧化,发生氧化反应,对应的氧化产物为ZnO,故答案为:降低;得到;Fe2O3;还原;氧化;还原;氧化;氧化;ZnO;Fe.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意从元素化合价角度分析,题目难度不大.

练习册系列答案
相关题目
核电荷数为1~20的元素中,次外层电子数是最外电子层电子数4倍的元素共有( )
| A、4种 | B、3种 | C、2种 | D、1种 |
将铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2即可产生电流,称为燃料电池.下列叙述正确的是( )
| A、通氧气的电极为负极,反应式为:O2+2H2O+4e=4OH- |
| B、正极附近的PH值减小,负极附近PH增大 |
| C、每当外电路转移4mol 电子时,电解质溶液中消耗2mol KOH |
| D、负极的电极反应式是:CH4+10OH--8e-=CO32-+7H2O |

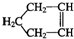 可简写为
可简写为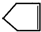 .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: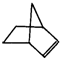
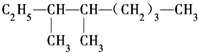 的系统命名法名称是
的系统命名法名称是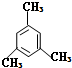 的名称是
的名称是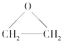 ),该反应的原子利用率为100%,反应的化学方程式为
),该反应的原子利用率为100%,反应的化学方程式为