题目内容
取2.86g Na2CO3?10H2O溶于水配成100ml溶液,求:
(1)Na2CO3物质的量浓度
(2)Na+ 物质的量浓度
(3)取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.04mol/L,求加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)
(1)Na2CO3物质的量浓度
(2)Na+ 物质的量浓度
(3)取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.04mol/L,求加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)
考点:物质的量浓度的相关计算
专题:计算题
分析:(1)根据n=
计算Na2CO3?10H2O的物质的量,碳酸钠与Na2CO3?10H2O的物质的量相等,根据c=
计算溶液物质的量浓度;
(2)溶液中c(Na+)=2c(Na2CO3);
(3)根据稀释定律计算稀释后溶液的体积,进而计算加入水的体积.
| m |
| M |
| n |
| V |
(2)溶液中c(Na+)=2c(Na2CO3);
(3)根据稀释定律计算稀释后溶液的体积,进而计算加入水的体积.
解答:
解:(1)2.86gNa2CO3?10H2O的物质的量=
=0.01mol,溶于水配成100ml溶液,碳酸钠与Na2CO3?10H2O的物质的量相等,溶液物质的量浓度=
=0.1mol/L,
答:碳酸钠溶液的浓度为0.1mol/L;
(2)溶液中c(Na+)=2c(Na2CO3)=2×0.1mol/L=0.2mol/L,
答:溶液中Na+物质的量浓度为0.2mol/L;
(3)根据稀释定律,稀释后溶液的体积=
=50mL,则加入水的体积=50mL-20mL=30mL,
答:需要加入水的体积为30mL.
| 2.86g |
| 286g/mol |
| 0.01mol |
| 0.1L |
答:碳酸钠溶液的浓度为0.1mol/L;
(2)溶液中c(Na+)=2c(Na2CO3)=2×0.1mol/L=0.2mol/L,
答:溶液中Na+物质的量浓度为0.2mol/L;
(3)根据稀释定律,稀释后溶液的体积=
| 20mL×0.1mol/L |
| 0.04mol/L |
答:需要加入水的体积为30mL.
点评:本题考查物质的量浓度有关计算,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
下列是工业上制备对苯二酚的两条合成线路,有关说法正确的是( )
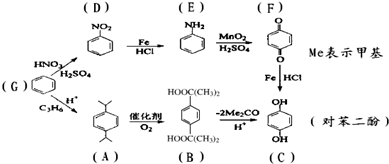

| A、G→D和D→E的反应都属于取代反应 |
| B、B有机物中含有的官能团是羧基 |
| C、G→A,A→B这两步反应都可以做到原子被100%利用 |
| D、对苯二酚可以发生取代、加成、还原、氧化、缩聚和水解反应 |
2011年10月11日在杭州举行的第八届全国残疾人运动会火炬给人们留下了深刻的印象,火炬使用的燃料为丙烷.下列关于丙烷的说法正确的是( )
| A、常温常压下为液体 |
| B、与丁烷互为同分异构体 |
| C、是甲烷的同系物 |
| D、能使酸性高锰酸钾溶液褪色 |
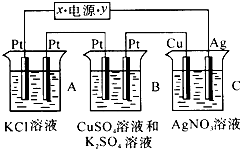 如图所示,若电解5min时铜电极质量增加2.16g,试回答:
如图所示,若电解5min时铜电极质量增加2.16g,试回答: