题目内容
 如图所示,若电解5min时铜电极质量增加2.16g,试回答:
如图所示,若电解5min时铜电极质量增加2.16g,试回答:(1)电源电极x名称为
(2)pH变化:B
(3)通电5min时,B中共收集到224mL气体(标况),溶液体积为200mL,则通电前CuSO4溶液的物质的量浓度为
(4)若A中KCl溶液的体积也是200mL,电解后,溶液的pH是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)由铜电极的质量增加,则Cu电极为阴极,可知X为电源的负极;
(2)B中电解硫酸铜溶液生成硫酸,pH减小,根据C中电极反应判断;
(3)根据电极反应及电子守恒来计算;
(4)根据A中的电极反应及与C中转移的电子守恒来计算.
(2)B中电解硫酸铜溶液生成硫酸,pH减小,根据C中电极反应判断;
(3)根据电极反应及电子守恒来计算;
(4)根据A中的电极反应及与C中转移的电子守恒来计算.
解答:
解:(1)由铜电极的质量增加,发生Ag++e-═Ag,则Cu电极为阴极,可知X为电源的负极,故答案为:负极;
(2)B中电解硫酸铜溶液生成硫酸,溶液中氢离子浓度增大,pH减小,C中C中阴极反应为Ag++e-═Ag,阳极反应为Ag-e-═Ag+,溶液浓度不变,则pH不变,
故答案为:减小;不变;
(3)C中阴极反应为Ag++e-═Ag,n(Ag)=
=0.02mol,则转移的电子为0.02mol,
B中阳极反应为4OH--4e-═2H2O+O2↑,则转移0.02mol电子生成氧气为0.005mol,其体积为0.005mol×22.4L/mol=0.112L=112mL,
则在阴极也生成112mL气体,由2H++2e-═H2↑,则氢气的物质的量为0.005mol,该反应转移的电子为0.01mol,
则Cu2++2e-═Cu中转移0.01mol电子,所以Cu2+的物质的量为0.005mol,通电前c(CuSO4)=
=0.025 mol?L-1;
故答案为:0.025 mol?L-1;
(4)由A中发生2KCl+2H2O
2KOH+H2↑+Cl2↑~2e-,
由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化,
则c(OH-)=
=0.1mol?L-1,溶液pH=13,
故答案为:13.
(2)B中电解硫酸铜溶液生成硫酸,溶液中氢离子浓度增大,pH减小,C中C中阴极反应为Ag++e-═Ag,阳极反应为Ag-e-═Ag+,溶液浓度不变,则pH不变,
故答案为:减小;不变;
(3)C中阴极反应为Ag++e-═Ag,n(Ag)=
| 2.16g |
| 108g/mol |
B中阳极反应为4OH--4e-═2H2O+O2↑,则转移0.02mol电子生成氧气为0.005mol,其体积为0.005mol×22.4L/mol=0.112L=112mL,
则在阴极也生成112mL气体,由2H++2e-═H2↑,则氢气的物质的量为0.005mol,该反应转移的电子为0.01mol,
则Cu2++2e-═Cu中转移0.01mol电子,所以Cu2+的物质的量为0.005mol,通电前c(CuSO4)=
| 0.005mol |
| 0.2L |
故答案为:0.025 mol?L-1;
(4)由A中发生2KCl+2H2O
| ||
由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化,
则c(OH-)=
| 0.02mol |
| 0.2L |
故答案为:13.
点评:本题考查电解原理,明确Cu电极的质量增加是解答本题的突破口,并明确发生的电极反应及电子守恒即可解答,注意计算时电子守恒的应用,题目难度中等.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
卫星发射时可用肼(N2H4)为燃料,1mol气态肼在适量氧气中燃烧,生成氮气和水蒸气,放出534KJ的热量.下列说法中正确的是( )
| A、1mol N2H4 (g)的能量比1molN2(g)的能量高534KJ |
| B、1mol N2H4 (g)的能量比1molN2(g)的能量低534KJ |
| C、1mol N2H4 (g)与1molO2(g)的总能量和比1molN2(g)和2molH2O(g)的总能量和高534KJ |
| D、1mol N2H4 (g)与1molO2(g)的总能量和比1molN2(g)和2molH2O(g)的总能量和低534KJ |

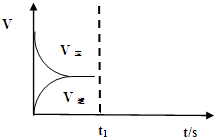 化工工业中常用乙苯脱氢的方法制备苯乙烯.已知某温度下:
化工工业中常用乙苯脱氢的方法制备苯乙烯.已知某温度下: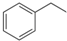 (g)?
(g)?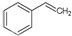 (g)+H2(g),△H=+117.6kJ/mol.
(g)+H2(g),△H=+117.6kJ/mol.