题目内容
化学实验是研究物质性质的基础.
(1)下列有关实验操作或测量数据合理的是 (填序号).
a.用铁坩埚加热CuSO4?5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20mL的量筒,量取16.8mL的Na2CO3溶液
(2)某废水样品中含有一定量的Na+、CO32-、SO32-,某研究小组欲测定其中SO32-的浓度.
实验方案:
ⅰ.用烧杯盛取废水适量,加少量活性炭,除去废水中的杂质;过滤,取滤液;
ⅱ.精确量取20.00mL过滤后废水试样,选择使用紫色的0.1mol?L-1 KMnO4(H2SO4酸化)溶液进行滴定;
ⅲ.记录数据,计算.
①下列滴定方式中,最合理的是(夹持部分略去) (填字母序号).
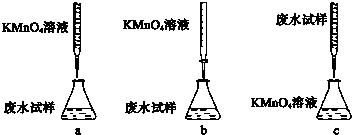
②滴定过程中,有关反应的离子方程式是 .
(3)某同学制备Fe(OH)3胶体:用洁净的烧杯取适量蒸馏水加热至沸腾,向烧杯中滴加1mol?L-1的FeCl3溶液,并不断用玻璃棒搅拌,结果溶液变浑浊.该同学制备胶体失败的原因是 ,你认为成功制得Fe(OH)3胶体的特征现象是 .
(1)下列有关实验操作或测量数据合理的是
a.用铁坩埚加热CuSO4?5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20mL的量筒,量取16.8mL的Na2CO3溶液
(2)某废水样品中含有一定量的Na+、CO32-、SO32-,某研究小组欲测定其中SO32-的浓度.
实验方案:
ⅰ.用烧杯盛取废水适量,加少量活性炭,除去废水中的杂质;过滤,取滤液;
ⅱ.精确量取20.00mL过滤后废水试样,选择使用紫色的0.1mol?L-1 KMnO4(H2SO4酸化)溶液进行滴定;
ⅲ.记录数据,计算.
①下列滴定方式中,最合理的是(夹持部分略去)

②滴定过程中,有关反应的离子方程式是
(3)某同学制备Fe(OH)3胶体:用洁净的烧杯取适量蒸馏水加热至沸腾,向烧杯中滴加1mol?L-1的FeCl3溶液,并不断用玻璃棒搅拌,结果溶液变浑浊.该同学制备胶体失败的原因是
考点:化学实验方案的评价,胶体的重要性质
专题:实验设计题,实验评价题
分析:(1)a.铁会和CuSO4发生置换反应;
b.浓硫酸有脱水性,可以使PH试纸脱水碳化;
C.量筒精确到0.1;
(2)①酸性高锰酸钾具有强氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管内,废水样品中含有一定量的Na+、CO32-、SO32-,呈碱性,溶液由无色变为有色,现象明显;
②高锰酸钾能将亚硫酸根氧化为硫酸根;
(3)搅拌能使胶体聚沉;将饱和的FeCl3溶液滴入沸水中,加热直到得到红褐色溶液.
b.浓硫酸有脱水性,可以使PH试纸脱水碳化;
C.量筒精确到0.1;
(2)①酸性高锰酸钾具有强氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管内,废水样品中含有一定量的Na+、CO32-、SO32-,呈碱性,溶液由无色变为有色,现象明显;
②高锰酸钾能将亚硫酸根氧化为硫酸根;
(3)搅拌能使胶体聚沉;将饱和的FeCl3溶液滴入沸水中,加热直到得到红褐色溶液.
解答:
解:(1)a.用铁坩埚加热CuSO4?5H2O,铁会和CuSO4发生置换反应,造成误差,故错误;
b.不能用干燥的pH试纸测定浓硫酸的pH,浓硫酸有脱水性,可以使PH试纸脱水碳化,不能与标准比色卡比较,故错误;
C.量筒精确到0.1,可量取16.8mL的Na2CO3溶液,故正确;
故答案为:c;
(2)①酸性高锰酸钾具有强氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管内,溶液由无色变为有色,现象明显,应用高锰酸钾滴定废水,
故答案为:b;
②高锰酸钾能将亚硫酸根氧化为硫酸根:5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O,
故答案为:5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O;
(3)制备Fe(OH)3胶体时,将饱和的FeCl3溶液滴入沸水中,加热直到得到红褐色溶液,不能搅拌,
故答案为:搅拌导致胶体聚沉;液体呈透明的红褐色.
b.不能用干燥的pH试纸测定浓硫酸的pH,浓硫酸有脱水性,可以使PH试纸脱水碳化,不能与标准比色卡比较,故错误;
C.量筒精确到0.1,可量取16.8mL的Na2CO3溶液,故正确;
故答案为:c;
(2)①酸性高锰酸钾具有强氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管内,溶液由无色变为有色,现象明显,应用高锰酸钾滴定废水,
故答案为:b;
②高锰酸钾能将亚硫酸根氧化为硫酸根:5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O,
故答案为:5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O;
(3)制备Fe(OH)3胶体时,将饱和的FeCl3溶液滴入沸水中,加热直到得到红褐色溶液,不能搅拌,
故答案为:搅拌导致胶体聚沉;液体呈透明的红褐色.
点评:本题考查化学实验方案的评价,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用石墨做电极电解下列溶液,电解完成后,向剩余的溶液中加入适量蒸馏水,能使溶液和电解前相同的是( )
| A、NaCl |
| B、Na2SO4 |
| C、HCl溶液 |
| D、AgNO3 |
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCuCO3后恰好恢复到电解前的浓度和pH.则电解过程中转移的电子数为( )
| A、0.1mol |
| B、0.2mol |
| C、0.3mol |
| D、0.4mol |
将一定质量的Mg,Zn,Al混合物与足量稀H2SO4反应,生成H22.8L(标准状况)原混合物的质量可能是( )
| A、2g | B、4g |
| C、7.8g | D、10g |
下列实验操作中正确的是( )
A、过滤时,如右图所示的装置进行操作 |
| B、蒸馏操作时,将温度计插入蒸馏烧瓶里的溶液中 |
| C、蒸发操作时,当混合物中的水分蒸干后停止加热 |
| D、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
一定温度下,对固定容器中的可逆反应A(g)+2B(g)?3C(g)的下列叙述中,能说明反应已达到平衡的是( )(A、B为无色气体,C为有色气体)
| A、混合气体的物质的量不再变化 |
| B、单位时间内消耗amolA,同时生成3amolC |
| C、容器内的压强不再变化 |
| D、容器内气体颜色不再变化 |
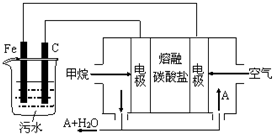 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示. 请回答下列实验室中制取气体的有关问题.
请回答下列实验室中制取气体的有关问题.