题目内容
18.A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素,A、B、C三种元素的原子序数之和为31,D元素与A、B、C三种元素既不同周期,也不同主族,请回答:(1)C元素在元素周期表中的位置是第三周期第ⅥA族;
(2)A、B、D可组成一种离子化合物,是常见的化肥,其化学式为NH4NO3;
(3)A2和D2两种物质可以构成一种新型的原电池,若原电池中电解质溶液为KOH溶液,则正极的电极反应式为O2+2H2O+4e-=4OH-;
(4)若将一充满20mLBA2和A2混合气体的大试管倒立于D2A中,充分反应后,在相同条件下,测得试管中余下5mL无色气体,则原混合气体中BA2和A2物质的量之比为3:2或9:1.
分析 A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31,则A、B、C可能有如下几种相对位置:
①设A的原子序数为x,则C为x-8,B为x+1,则x+x-8+x+1=31,解之得:x=$\frac{38}{3}$,不符合题意;
②设A的原子序数为x,则C为x-8,B为x-1,则x+x-8+x-1=31,解之得:x=$\frac{40}{3}$,不符合题意;
③设A的原子序数为x,则C为x+8,B为x+1,则x+x+8+x+1=31,解之得:x=$\frac{22}{3}$,不符合题意;
④设A的原子序数为x,则C为x+8,B为x-1,则x+x+8+x-1=31,解之得:x=8,则A为O元素,B为N元素,C为S元素,D元素与A、B、C三种元素既不是同周期,也不同主族,且为短周期元素,应为H元素,根据原子的结构以及物质的性质解答该题.
解答 解:A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31,则A、B、C可能有如下几种相对位置:
①设A的原子序数为x,则C为x-8,B为x+1,则x+x-8+x+1=31,解之得:x=$\frac{38}{3}$,不符合题意;
②设A的原子序数为x,则C为x-8,B为x-1,则x+x-8+x-1=31,解之得:x=$\frac{40}{3}$,不符合题意;
③设A的原子序数为x,则C为x+8,B为x+1,则x+x+8+x+1=31,解之得:x=$\frac{22}{3}$,不符合题意;
④设A的原子序数为x,则C为x+8,B为x-1,则x+x+8+x-1=31,解之得:x=8,则A为O元素,B为N元素,C为S元素,D元素与A、B、C三种元素既不是同周期,也不同主族,且为短周期元素,应为H元素,
(1)C为S元素,原子核外有3个电子层,最外层电子为6,位于周期表中第三周期第ⅥA族,
故答案为:第三周期第ⅥA族;
(2)O、N、H可组成离子化合物,是一种常见的速效化肥,其化学式为:NH4NO3,
故答案为:NH4NO3;
(3)O2和H2两种物质可以构成一种新型的原电池,若原电池中电解质溶液为KOH溶液,氢气与氧气燃烧的总化学方程式为2H2+O2=2H2O,电解质溶液呈碱性,则正极:O2+2H2O+4e-=4OH-,负极的电极方程式为:2H2+4OH-=4H2O+4e-,
故答案为:O2+2H2O+4e-=4OH-;
(4)若将一充满20mL NO2和O2混合气体的大试管倒立于H2O中,充分反应后,在相同条件下,测得试管中余下5mL无色气体,二氧化氮和氧气和水反应方程式为4NO2+O2+2H2O=4HNO3,剩余气体可能是O2,也可能是NO,
当剩余气体是O2时,根据方程式知,二氧化氮的体积=$\frac{20mL-5mL}{5}$×4=12mL,原混合气体中氧气的体积为:20mL-12mL=8mL,相同条件下物质的量之比等于气体体积之比,则原混合气体中NO2和O2物质的量之比=12mL:8mL=3:2;
当剩余气体是NO时,根据3NO2+H2O=2HNO3+NO知,与水反应的二氧化氮体积为一氧化氮的2倍,为5mL×2=10mL,再结合4NO2+O2+2H2O=4HNO3知,混合气体中
氧气的体积为:$\frac{20mL-10mL}{5}$×1=2mL,原混合气体中NO2的体积为:20mL-2mL=18mL,相同条件下物质的量之比等于气体体积之比,则原混合气体中NO2和O2物质的量之比=18mL:2mL=9:1,
故答案为:3:2 或 9:1.
点评 本题考查位置、结构与性质关系的综合应用,题目浓度较大,通过讨论推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,(4)为难点、易错点,注意把握讨论法在化学计算中的应用.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案| A. | 2:3 | B. | 3:1 | C. | 1:1 | D. | 3:2 |
①将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-5 | 6×10-5 | 2×10-4 | 4×10-4 | 3×10-4 | 2×10-4 |
②汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图3:
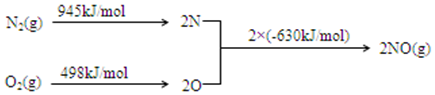
则:NO(g)?$\frac{1}{2}$N2(g)+$\frac{1}{2}$O2(g)△H=-91.5kJ•mol-1.
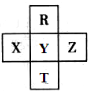 元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸.则下列判断错误的是( )
元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸.则下列判断错误的是( )| A. | 原子半径 Z>Y>R | B. | R与Y的电子数相差8 | ||
| C. | 非金属性:Z>Y>X | D. | HZO4是目前无机酸中最强的含氧酸 |
| A. | 元素的性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素的性质随着原子序数的递增而呈周期性变化 | |
| C. | 周期表中的主族中都既有非金属元素又有金属元素 | |
| D. | 原子的最外层电子数相同的元素,一定属于同一族 |
| A. | 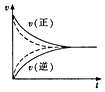 用实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化 | |
| B. | 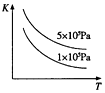 表示反应2SO2(g)+O2(g)?2SO3(g)△H<0的平衡常数K与温度和压强的关系 | |
| C. | 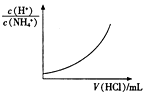 表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$随HCl溶液体积变化关系 | |
| D. | 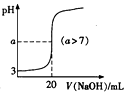 表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系 |
 酚酞是白色结晶,在空气中稳定,几乎不溶于水,常用做酸碱指示剂,其结构简式如图:
酚酞是白色结晶,在空气中稳定,几乎不溶于水,常用做酸碱指示剂,其结构简式如图: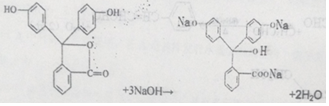 .
.


