题目内容
18.根据原子结构及元素周期律的知识,下列推断正确的是( )| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| C. | 核外电子排布相同的微粒化学性质也相同 | |
| D. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 |
分析 A.同主族自上而下非金属性减弱,最高价含氧酸的酸性减弱;
B.四种离子的电子层数相同,核电荷数越大,离子半径越小;
C.核外电子排布相同的微粒化学性质不一定相同,如S2-、Ar、K+;
D.3517Cl与3717Cl互为同位素,化学性质相同.
解答 解:A.同主族自上而下非金属性减弱,最高价含氧酸的酸性减弱,不是最高价含氧酸,则不一定,故A错误;
B.Cl-、S2-、Ca2+、K+都含有3个电子层,核电荷数越大,离子半径越小,则离子半径大小顺序为:S2->Cl->K+>Ca2+,故B错误;
C.核外电子排布相同的微粒化学性质不一定相同,如S2-、Ar、K+,但互为同位素原子时化学性质相同,故C错误;
D.3517Cl与3717Cl的质子数相同、中子数不同,二者互为同位素,其化学性质相同,则二者的得电子能力相同,故D正确;
故选D.
点评 本题考查了元素周期表结构及应用,题目难度不大,明确原子结构与元素周期表的关系为解答关键,C选项中注意利用列举反例法解答,A为易错点,学生容易忽略最高价含氧酸.

练习册系列答案
相关题目
9.蛋白质的元素组成比油脂多了下列哪种元素( )
| A. | 氢 | B. | 氮 | C. | 氧 | D. | 硅 |
10.下列有关水的说法正确的是( )
| A. | 每一个水分子内含有两个氢键 | |
| B. | 水分子的空间构型为V形 | |
| C. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| D. | 水是良好的溶剂,易溶解HCl、CH4等气体 |
7.下列化学现象及解释错误的是( )
| 选项 | 现象 | 解释 |
| A | Cl2在H2中点燃,瓶口有白雾 | 生成HCl极易溶于水 |
| B | 饱和Na2CO3溶液中通入CO2析出白色晶体 | 生成NaHCO3溶解度小析出 |
| C | 常温下将铝片放入浓硝酸中无明显变化 | Al和浓硝酸不反应 |
| D | SO2通入溴水,溴水褪色 | SO2具有还原性. |
| A. | A | B. | B | C. | C | D. | D |
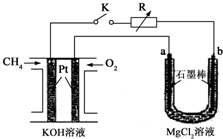 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源进行氯化镁溶液电解实验,电解装置如图所示.请回答下列问题:
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源进行氯化镁溶液电解实验,电解装置如图所示.请回答下列问题: .
. .
.