题目内容
下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是( )
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是
c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.碳酸钠溶液中滴加少量氯水的离子方程式为CO32-+Cl2=HCO3-+Cl-+HClO
C.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
D.向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3溶液,CrO42-先形成沉淀
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| KSP或Ka | KSP=1.8×10-10 | KSP=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.碳酸钠溶液中滴加少量氯水的离子方程式为CO32-+Cl2=HCO3-+Cl-+HClO
C.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
D.向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3溶液,CrO42-先形成沉淀
C
试题分析:根据电离平衡常数可知酸性强弱顺序为:CH3COOH>HClO,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的pH越大,所以相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)> c(CH3COO-)>c(ClO-)> c(OH-)>c(H+),故A错误;碳酸的酸性强于次氯酸的,但次氯酸的酸性强于HCO3-,所以碳酸钠溶液中滴加少量氯水的离子方程式为H2O+CO32-+Cl2=HCO3-+Cl-+HClO,所以B不正确;选项C中根据电离平衡常数可知,
 ,由于c(CH3COOH):c(CH3COO-)=5:9,所以氢离子的浓度是10-5mol/L,则pH=5,故C正确;当溶液中氯离子和CrO42-浓度均为0.001mol/L时,要生成相应的沉淀,则需要银离子的浓度分别是
,由于c(CH3COOH):c(CH3COO-)=5:9,所以氢离子的浓度是10-5mol/L,则pH=5,故C正确;当溶液中氯离子和CrO42-浓度均为0.001mol/L时,要生成相应的沉淀,则需要银离子的浓度分别是 、
、 4.47×10-5mol/L,所以首先析出的沉淀是氯化银,选项D不正确,答案选C。
4.47×10-5mol/L,所以首先析出的沉淀是氯化银,选项D不正确,答案选C。点评:该题是中等难度的试题,试题综合性强,贴近高考,有利于调动学生的学习兴趣,激发学生的学习积极性。在解答涉及离子浓度大小比较时要注意外界条件对电离平衡的影响,利用电荷守恒、质量守恒解答此类题目。

练习册系列答案
相关题目

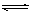 CH3COO-+H+,加少量烧碱溶液可使溶液中
CH3COO-+H+,加少量烧碱溶液可使溶液中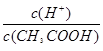 值增大。
值增大。