题目内容
6.利用相关知识进行填空:(1)从100ml 1mol/L的NaHCO3溶液中取出10ml,这10ml溶液的物质的量浓度为1mol/L.
(2)质量相同的O2和O3所含的分子数之比为3:2,原子数之比为1:1.
(3)19g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量为95g/mol,A的相对原子质量为24,ACl2的化学式为MgCl2.
分析 (1)溶液是均一的,取出溶液、剩余溶液浓度均与原溶液浓度相等;
(2)根据n=$\frac{m}{M}$计算物质的量之比,分子数目之比等于其物质的量之比,结合分子式计算氧原子数目之比;
(3)根据含有氯离子计算ACl2的物质的量,再根据M=$\frac{m}{n}$计算ACl2的摩尔质量,进而计算A的相对分子质量,再确定ACl2的化学式.
解答 解:(1)溶液是均一的,取出10mL溶液浓度均与原溶液浓度相等,即取出10ml溶液的物质的量浓度为1mol/L,故答案为:1mol/L;
(2)根据n=$\frac{m}{M}$可知,质量相同的O2和O3的物质的量组织部为48g/mol:32g/mol=3:2,则二者还愿意分子数目之比为3:2,含有氧原子数目之比为3×2:2×3=1:1,故答案为:3:2;1:1;
(3)ACl2的物质的量为$\frac{0.4mol}{2}$=0.2mol,ACl2的摩尔质量为$\frac{19g}{0.2mol}$=95g/mol,故A的相对分子质量为95-71=24,则A为Mg,故ACl2的化学式为MgCl2,故答案为:95g/mol; 24; MgCl2.
点评 本题考查物质的量有关计算,难度不大,注意掌握以物质的量为中心的计算,有利于基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列各组离子在水溶液中能够大量共存的是( )
| A. | H+、CO32-、NO3- | B. | Cu2+、Cl-、OH- | C. | Na+、Cl-、HCO3- | D. | Ag+、K+、Cl- |
1.下列化学用语表示正确的是( )
| A. | 原子核中有7个中子的碳原子:12C | |
| B. | 明矾的电离方程式是:KAl(SO4)2•12H2O═K++Al3++2SO42-+12H2O | |
| C. | K+结构示意图: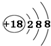 | |
| D. | Ba(OH)2与H2SO4反应的化学方程式是:Ba(OH)2+H2SO4═BaSO4↓+H2O |
11.下列物质中,可用作净水剂的是( )
| A. | 纯碱 | B. | 明矾 | C. | 蔗糖 | D. | 火碱 |
18.下列物质属于弱电解质的是( )
| A. | 蔗糖 | B. | 一水合氨 | C. | 醋酸钠 | D. | 氨水 |
15.相同温度下,pH=3的盐酸和pH=3的醋酸溶液,由水电离产生的c(H+)( )
| A. | 前者小于后者 | B. | 前者大于后者 | C. | 前者等于后者 | D. | 不能确定 |
16.可用于区别溴蒸气与二氧化氮气体的试剂是( )
①淀粉碘化钾溶液②水③AgNO3溶液④NaOH溶液.
①淀粉碘化钾溶液②水③AgNO3溶液④NaOH溶液.
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③④ |