题目内容
某课外小组做了一个有趣的实验,将2g铝粉和3g碘粉小心混合均匀,分成相等三份,分别进行实验,现将实验记录列表:
根据上述实验事实,作出的推断错误的是( )
| 第一组 | 加入0.5g水 | 很快产生火花 |
| 第二组 | 加入1g胆矾 | 约30s产生火花 |
| 第三组 | 加入1g无水硫酸铜 | 1min内没有明显现象 |
| A、水能加快铝和碘的反应 |
| B、第三组铝和硫酸铜发生了置换反应 |
| C、第一组和第二组实验中均放出热量 |
| D、第一组实验中铝和碘发生反应生成了AlI3 |
考点:性质实验方案的设计
专题:信息给予题
分析:A.对比三组实验现象可知,水在铝和碘的反应中起到催化作用;
B.第三组中加热1个无水硫酸铜后,1min内没有明显现象,说明固态的铝和硫酸铜之间没有发生反应;
C.金属铝和碘的化合反应为放热反应;
D.金属铝和单质碘会发生反应,铝在产物中化合价为+3,碘元素的化合价为-1价的碘离子,据此判断反应产物.
B.第三组中加热1个无水硫酸铜后,1min内没有明显现象,说明固态的铝和硫酸铜之间没有发生反应;
C.金属铝和碘的化合反应为放热反应;
D.金属铝和单质碘会发生反应,铝在产物中化合价为+3,碘元素的化合价为-1价的碘离子,据此判断反应产物.
解答:
解:A.把铝粉和碘粉小心混合均匀,加入0.5g水,很快产生火花,说明水在铝和碘的反应中起了催化作用,故A正确;
B.根据“1min内没有明显现象”可知,金属铝和硫酸铜的固体没有反应,故B错误;
C.金属铝和碘单质的反应为化合反应,反应中会放出热量,故C正确;
D.金将铝粉和碘粉小心混合均匀,加入水,很快产生火花,说明铝和碘发生了化学反应,反应产物应该为AlI3,故D正确;
故选B.
B.根据“1min内没有明显现象”可知,金属铝和硫酸铜的固体没有反应,故B错误;
C.金属铝和碘单质的反应为化合反应,反应中会放出热量,故C正确;
D.金将铝粉和碘粉小心混合均匀,加入水,很快产生火花,说明铝和碘发生了化学反应,反应产物应该为AlI3,故D正确;
故选B.
点评:本题考查的性质实验方案的设计与评价,题目难度中等,注意掌握常见元素单质及其化合物性质,明确题干中各组实验现象的差异为解题关键,试题充分考查了学生的分析、理解能力及综合应用能力.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-12CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ?mol-1H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1下列说法正确的是( )
| A、H2(g)的燃烧热为571.6 kJ?mol-1 | ||||||
| B、同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | ||||||
C、
| ||||||
| D、3H2(g)+CO2(g)=CH3OH(l)+H2O(l)△H=+135.9 kJ?mol-1 |
人体中正常的血红蛋白中含有Fe2+,若误食亚硝酸盐,则导致血红蛋白中的Fe2+转化高铁(Fe3+)血红蛋白而中毒,服用维生素C可解除亚硝酸盐中毒.下列叙述中正确的是( )
| A、亚硝酸盐是还原剂 |
| B、维生素C发生还原反应 |
| C、维C将Fe3+转化成Fe2+ |
| D、亚硝酸盐被氧化 |
实验室里需用495mL 0.1mol/L的硫酸铜溶液,以下操作正确的是( )
| A、称取7.68 g硫酸铜,加入500 mL水 |
| B、称取12.5 g胆矾配成500 mL溶液 |
| C、称取8.0 g硫酸铜,加入500 mL水 |
| D、称取12.0 g胆矾配成500 mL溶液 |
关于溶液、胶体和浊液的下列说法正确的是( )
| A、溶液稳定,胶体和浊液都不稳定 |
| B、溶液中的分散质能通过滤纸但不能通过半透膜 |
| C、溶液和胶体的本质区别在于是否能产生丁达尔效应 |
| D、NaCl溶液和CaCO3悬浊液的本质区别是分散质粒子的大小 |
下列物质中的杂质(括号内)可用加热的方法除去的是( )
| A、CO2(CO) |
| B、NaHCO3(Na2CO3) |
| C、Na2CO3(NaHCO3) |
| D、NaOH(NaHCO3) |
下列仪器使用时不允许用酒精灯加热的是( )
| A、量筒 | B、蒸馏烧瓶 |
| C、试管 | D、烧杯 |
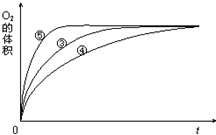 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.