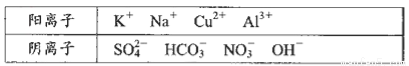题目内容
短周期主族元素X、Y、Z、W在元素周期表中的相对位置如下图所示。

已知X的最低负价与Y的最高正价代数和为零,下列说法正确的是
A.原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X)
B.Z的最高价氧化物的水化物酸性比W的强
C.X的简单气态氢化物的稳定性比W的弱
D.X分别与Y、Z形成的化合物中化学键类型相同
A
【解析】
试题分析:A.同一周期的元素,原子序数越大,原子半径就越小,不同周期的元素,原子核外电子层数越多,原子半径就越大,所以原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X),正确;B.同一周期的元素,原子序数越大,元素的非金属性就越强,其最高价氧化物对应的水化物的酸性就越强,所以Z的最高价氧化物的水化物酸性比W的弱,错误;C.同一周期的元素,原子序数越大,元素的非金属性就越强,同一主族的元素,原子核外电子层数越少,元素的非金属性就越强,元素的非金属性越强,其氢化物的稳定性就越强,元素的非金属性X>W,所以X的简单气态氢化物的稳定性比W的强,错误;D.根据元素在周期表的相对位置可知X是O,Y是Mg,Z是Si;W是P,X分别与Y形成的化合物中化学键类型是离子键,X与Z形成的化合物中化学键类型是共价键,类型不同,错误。
考点:考查元素的推断及元素的原子结构、位置与性质的关系的知识。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案(16分)A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
阳离子 | Na+、Al3+、Ba2+、NH4+ |
阴离子 | Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下:
①A、D溶液呈碱性,B呈酸性,C呈中性
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试纸变蓝
回答下列问题:
(1)A的化学式是_________,用电子式表示C的形成过程:________________ 。
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,所得溶液中各离子物质的量浓度由大到小的顺序是:________________________ 。
(3)写出③的离子方程式_______________________________________________ 。
(4)简述D溶液呈碱性的理由___________________________________________ 。
25℃时,0.1mol·L-1下列溶液的pH如下表,有关比较错误的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3C | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸的强度:HF>H2CO3
B.由水电离产生的c(H+):①=②
C.溶液中酸根离子浓度:c(F-)>c(HCO3-)
D.序号④中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1mol·L-1
 BCl3空间形状为 (用文字描述)。
BCl3空间形状为 (用文字描述)。 键数目为 。
键数目为 。
 OONH4
OONH4