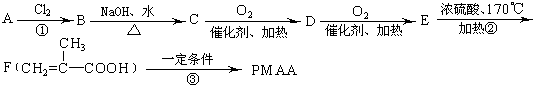
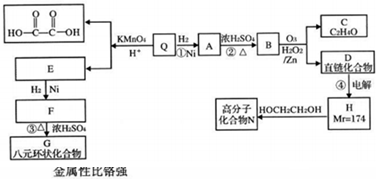
题目内容
如图为某实验者设计的验证银圆(银和铜的合金)完全溶解于一定量的浓硝酸后生成NO2气体中含有NO的实验装置图.常温时,NO2与N2O4同时存在;在低于0℃时,几乎只有无色的N2O4的晶体存在.
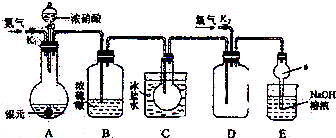
(1)反应前先打开A中的活塞K1,持续通一段时间N2,其理由是 .
(2)若装置中缺B,其后果是 .
(3)反应结束后,打开D中的活塞K2,并通入氧气,D瓶内气体由无色变为红棕色;若通入的是热氧气,则瓶内气体的颜色比以前更深,其原因是 .
(4)C装置的作用是 ;E中a仪器所起的作用是 .
(5)已知该银圆的质量为25g,加入75mL 12mol?L-1的浓硝酸.实验结束后,A中烧瓶内溶液中H+的浓度为2mol?L-1(反应中HNO3既无挥发也无分解),溶液体积仍为75mL.
①参加反应的硝酸的物质的量是 .
②为测定该银圆中铜的质量分数,还需进行的主要实验操作是 .

(1)反应前先打开A中的活塞K1,持续通一段时间N2,其理由是
(2)若装置中缺B,其后果是
(3)反应结束后,打开D中的活塞K2,并通入氧气,D瓶内气体由无色变为红棕色;若通入的是热氧气,则瓶内气体的颜色比以前更深,其原因是
(4)C装置的作用是
(5)已知该银圆的质量为25g,加入75mL 12mol?L-1的浓硝酸.实验结束后,A中烧瓶内溶液中H+的浓度为2mol?L-1(反应中HNO3既无挥发也无分解),溶液体积仍为75mL.
①参加反应的硝酸的物质的量是
②为测定该银圆中铜的质量分数,还需进行的主要实验操作是
考点:性质实验方案的设计
专题:
分析:铜银合金与浓硝酸反应生成硝酸铜、硝酸银以及二氧化氮气体,如硝酸浓度降低时可能生成NO,经B浓硫酸干燥后,在C中冷却,NO2完全转化生成N2O4,D中气体通入氧气,如有NO,则可生成红综合的NO2气体,最后用氢氧化钠溶液吸收尾气,防止污染空气,利用A装置中反应后的溶液加入盐酸溶液,生成AgCl沉淀,经过滤、洗涤、干燥后称量可确定银的质量,进而可测得铜的质量分数;
根据n=cV计算原硝酸中硝酸的物质的量,氢离子浓度计算剩余的硝酸的物质的量,二者之差为参加反应的硝酸的物质的量,以此解答该题.
根据n=cV计算原硝酸中硝酸的物质的量,氢离子浓度计算剩余的硝酸的物质的量,二者之差为参加反应的硝酸的物质的量,以此解答该题.
解答:
解:(1)NO易于空气中的氧气反应生成NO2,为检验NO的存在,应首先去除装置内的氧气,
故答案为:排除系统内的空气,防止生成的NO被空气中的O2氧化;
(2)本实验目的是验证铜与浓硝酸反应,生成的NO2气体中含有NO,而水与NO2或N2O4反应,生成NO,干扰NO的验证,实验时应对气体进行干燥,
故答案为:无法确认铜与硝酸反应是否生成了NO气体;
(3)反应结束后,打开D部分的活塞k2,并通入氧气,D瓶内气体由无色变为红棕色,发生的反应为2NO+O2═2NO2,红棕色的NO2转化为无色N2O4气体的反应为放热反应,升高温度时,平衡向左移动,NO2的物质的量浓度增大,颜色加深,
故答案为:热的空气使平衡2NO2?N2O4向左移动,NO2的物质的量浓度增大,颜色加深;
(4)检验NO是否存在的方法是在NO的容器中通入氧气生成红棕色的NO2气体,为避免NO2气体的干扰,应将NO2全部转化成N2O4晶体,NO2易溶于水,应防止倒吸,
故答案为:NO2全部转化成N2O4晶体,避免在D装置中对NO的验证产生干扰; 防止倒吸;
(5)①原硝酸中硝酸的物质的量为0.075L×12mol/L=0.9mol,反应后氢离子浓度为2mol/L,故剩余的硝酸的物质的量为0.075L×2mol/L=0.15mol,故参加反应的硝酸的物质的量为0.9mol-0.15mol=0.75mol,
故答案为:0.75mol;
②向反应后反应中加入足量的盐酸至不再生成沉淀,过滤、洗涤沉淀、干燥,称量沉淀的质量,根据氯化银沉淀的质量计算银的质量,进而确定铜的质量分数;
故答案为:向反应后反应中加入足量的盐酸至不再生成沉淀,过滤、洗涤沉淀、干燥,称量沉淀的质量.
故答案为:排除系统内的空气,防止生成的NO被空气中的O2氧化;
(2)本实验目的是验证铜与浓硝酸反应,生成的NO2气体中含有NO,而水与NO2或N2O4反应,生成NO,干扰NO的验证,实验时应对气体进行干燥,
故答案为:无法确认铜与硝酸反应是否生成了NO气体;
(3)反应结束后,打开D部分的活塞k2,并通入氧气,D瓶内气体由无色变为红棕色,发生的反应为2NO+O2═2NO2,红棕色的NO2转化为无色N2O4气体的反应为放热反应,升高温度时,平衡向左移动,NO2的物质的量浓度增大,颜色加深,
故答案为:热的空气使平衡2NO2?N2O4向左移动,NO2的物质的量浓度增大,颜色加深;
(4)检验NO是否存在的方法是在NO的容器中通入氧气生成红棕色的NO2气体,为避免NO2气体的干扰,应将NO2全部转化成N2O4晶体,NO2易溶于水,应防止倒吸,
故答案为:NO2全部转化成N2O4晶体,避免在D装置中对NO的验证产生干扰; 防止倒吸;
(5)①原硝酸中硝酸的物质的量为0.075L×12mol/L=0.9mol,反应后氢离子浓度为2mol/L,故剩余的硝酸的物质的量为0.075L×2mol/L=0.15mol,故参加反应的硝酸的物质的量为0.9mol-0.15mol=0.75mol,
故答案为:0.75mol;
②向反应后反应中加入足量的盐酸至不再生成沉淀,过滤、洗涤沉淀、干燥,称量沉淀的质量,根据氯化银沉淀的质量计算银的质量,进而确定铜的质量分数;
故答案为:向反应后反应中加入足量的盐酸至不再生成沉淀,过滤、洗涤沉淀、干燥,称量沉淀的质量.
点评:本题考查铜、银与浓硝酸反应,生成的NO2气体中含有NO的验证实验,题目难度中等,做题时注意把握物质的性质,排除物质的相互干扰,利用守恒思想计算.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
“分类”是一种思想方法,在化学发展中起到了重要作用.下列说法正确的是( )
| A、氧化还原反应中,一种元素化合价升高,一定有另一种元素化合价降低 |
| B、根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 |
| C、根据水溶液能否导电将化合物分为电解质和非电解质 |
| D、碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 |
设NA为阿伏加德罗常数的数值,则下列说法正确的是( )
| A、2.24 L C4H6中含有碳碳叁键数一定为0.1×6.02×1023 |
| B、在标准状态下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA |
| C、含1molFeCl3的饱和溶液滴入沸水中得到氢氧化铁胶体粒子数目为NA |
| D、120g NaHSO4固体中的离子总数为2NA |
常温下,下列各组粒子在指定溶液中一定能大量共存的是( )
| A、使甲基橙变红的溶液中:Ag(NH3)2+、H+、Na+、NO3- |
| B、0.1 mol?L-1 Fe3+溶液中:Cl-、SO42-、K+、C6H5OH |
| C、“84”消毒液的水溶液中:K+、Cl-、Na+、OH- |
| D、通入过量SO2气体的溶液中:K+、NO3-、Ba2+、Cl- |
某溶液中可能含有SO42-、CO32-、Cl-,为了检验其中是否含有SO42-,除BaCl2液外,还需要的溶液是( )
| A、H2SO4 |
| B、HCl |
| C、NaOH |
| D、NaNO3 |
下列事实不能用勒夏特列原理解释的是( )
| A、由H2、I2(g)、HI组成的平衡体系,加压(缩体积)后颜色加深 |
| B、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| C、实验室中常用排饱和食盐水的方法收集氯气 |
| D、合成氨中增加N2的物质的量浓度可提高H2的转化率 |