题目内容
3.(1)1.7g NH3有1mol质子,(2)0.1mol H2O共有6.01×1023个电子
(3)9.03×1023个CO2的物质的量1.5 mol,其中,含有1.5mol C,1.806×1024个O.
分析 (1)根据n=$\frac{m}{M}$计算氨气的物质的量,每个分子含有10个质子;
(2)每个水分子含有10个电子,电子物质的量为水分子的10倍,再根据N=nNA计算;
(3)根据n=$\frac{N}{{N}_{A}}$计算二氧化碳的物质的量,碳原子物质的量等于二氧化碳的物质的量,氧原子数目为二氧化碳分子的2倍.
解答 解:(1)1.7g 氨气的物质的量为$\frac{1.7g}{17g/mol}$=0.1mol,每个分子含有10个质子,含有质子物质的量为0.1mol×10=1mol,故答案为:1;
(2)每个水分子含有10个电子,0.1mol H2O共有电子为0.1mol×10×6.02×1023mol-1=6.02×1023,
故答案为:6.02×1023;
(3)9.03×1023个CO2的物质的量$\frac{9.03×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1.5mol,含有碳原子为1.5mol,含有氧原子为9.03×1023×2=1.806×1024,
故答案为:1.5;1.5;1.806×1024.
点评 本题考查物质的量有关计算,掌握以物质的量为中心的计算,注意对化学式意义的理解,旨在考查学生对基础知识的巩固.

练习册系列答案
相关题目
13.下列物质属于可溶性的是( )
| A. | Fe(OH)3 | B. | Cu(OH)2 | C. | Al(OH)3 | D. | Ba(OH)2 |
14.下列属于苯的同系物的是( )
| A. |  | B. |  | C. |  | D. |  |
8.居里夫人因对Ra(镭)元素的研究两次获得诺贝尔奖.人们在测定物质放射性时通常用${\;}_{88}^{226}$Ra作为标准.下列有关${\;}_{88}^{226}$Ra的说法不正确的是( )
| A. | ${\;}_{88}^{226}$Ra的质量数为226,在数值上等于该原子的近似相对原子质量 | |
| B. | Ra元素位于周期表中第六周期第ⅡA族 | |
| C. | ${\;}_{88}^{226}$Ra元素的金属性比Mg的强 | |
| D. | Ra的最高价氧化物对应的水化物是强碱 |
15.某烃不与溴水反应,能使酸性高锰酸钾溶液褪色,在Fe存在下与Cl2反应,能生成两种一氯代物,该烃是( )
| A. | CH≡C-CH3 | B. | 对二甲苯 | ||
| C. | 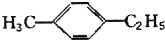 | D. | 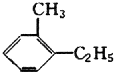 |
12.填写下表中的空格:
| 微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 |
| (1)${\;}_{19}^{40}$K | 19 | 40 | ||
| (2) | 16 | 18 | 32 |
13.下列化学式既能表示物质的组成,又能表示物质的一个分子的是( )
| A. | NaOH | B. | SiO2 | C. | Fe | D. | P4 |
 ”标志的是c(选填字母).
”标志的是c(选填字母).