题目内容
7.如何由AlCl3溶液制得无水AlCl3:在干燥的HCl氛围中加热蒸干氯化铝溶液.分析 氯化铝溶液中,铝离子水解生成氢氧化铝和氢离子,导致溶液显示酸性,实质是:Al3++3H2O?Al(OH)3+3H+,把AlCl3溶液蒸干灼烧,水解平衡向右移动,生成氢氧化铝,同时盐酸挥发,最后得到的主要固体产物是氢氧化铝,所以要抑制水解,使水解平衡逆向移动.
解答 解:氯化铝溶液中,铝离子水解生成氢氧化铝和氢离子,导致溶液显示酸性,实质是:Al3++3H2O?Al(OH)3+3H+,把AlCl3溶液蒸干灼烧,水解平衡向右移动,生成氢氧化铝,同时盐酸挥发,最后得到的主要固体产物是氢氧化铝,所以要抑制水解,使水解平衡逆向移动,在氯化氢氛围中加热蒸干,故答案为:在干燥的HCl氛围中加热蒸干氯化铝溶液.
点评 本题考查盐类的水解以及铝的化合物知识,侧重于基础知识的考查,为高频考点,注意把握盐类水解的原理以及影响因素,难度不大,注意相关基础知识的积累.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
17.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,18gD2O中所含的电子数为10NA | |
| B. | 200mL0.5mol•L-1的Na2CO3溶液中,由于CO32-水解,所以阴离子数目小于0.1NA | |
| C. | 精炼铜时,当阳极质量减少6.4g时,电路中转移电子数不一定为0.2NA | |
| D. | 5.6g铁与足量稀硫酸反应失去电子数为0.3NA |
18.管道工人利用浓氨水检查氯气管道是否漏气.已知能发生反应:2NH3+3Cl2═N2+6HCl,下列说法正确的是
( )
( )
| A. | 反应中化合价升高的元素是NH3中的H | |
| B. | 该反应利用了Cl2的强还原性 | |
| C. | NH3在反应中得到电子 | |
| D. | 生成1molN2有6mol电子转移 |
16.下列说法不正确的是( )
| A. | SO${\;}_{4}^{2-}$的摩尔质量是96g/mol | |
| B. | 1molH2中含有2molH | |
| C. | 1molH2O的质量等于NA个H2O质量的总和 | |
| D. | 1molO2的质量为32g/mol |
10. 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-246.4 kJ•mol-1.
(3)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是bce.
a.高温低压 b.低温高压
c.减少CO2的浓度 d.增加CO的浓度
e.分离出二甲醚 f.加入催化剂
(4)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
比较此时正、逆反应速率的大小:v正>v逆(填“>”、“<”或“=”),若上述情况达到平衡,此时c(CH3OH)=0.04 mol•L-1.
(5)将CH4设计成燃料电池,其装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.
①0<V≤44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O;
②44.8L<V≤89.6L时,负极电极反应为CH4-8e-+9CO32-+3H2O=10HCO3-;
③V=67.2L时,溶液中阴离子浓度大小关系为c(HCO3-)>c(CO32-)>c(OH-).
 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-246.4 kJ•mol-1.
(3)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是bce.
a.高温低压 b.低温高压
c.减少CO2的浓度 d.增加CO的浓度
e.分离出二甲醚 f.加入催化剂
(4)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
(5)将CH4设计成燃料电池,其装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.
①0<V≤44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O;
②44.8L<V≤89.6L时,负极电极反应为CH4-8e-+9CO32-+3H2O=10HCO3-;
③V=67.2L时,溶液中阴离子浓度大小关系为c(HCO3-)>c(CO32-)>c(OH-).
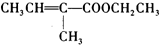 ;以化合物A为原料合成F的工艺流程如图:
;以化合物A为原料合成F的工艺流程如图:

 .
.
 如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀.如表中液体X和固体Y的组合,不符合题意的是( )
如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀.如表中液体X和固体Y的组合,不符合题意的是( )