题目内容
15.已知分解100g CaCO3需要177.7kJ的热量,而12g碳完全燃烧,则放出393kJ的热.求:(1)煅烧1t石灰石需要多少热量?
(2)这些热量全部由碳燃烧提供,问理论上要消耗多少克碳?
分析 (1)根据碳酸钙质量与需要的热量呈正比关系计算;
(2)根据(1)计算可知需要总热量,再根据碳的质量与放出的热量呈正比关系计算.
解答 解:(1)分解100g CaCO3需要177.7kJ的热量,煅烧1t石灰石需要热量为177.7kJ×$\frac{1×1{0}^{6}g}{100g}$=1777000kJ,
答:煅烧1t石灰石需要1777000kJ热量;
(2)12g碳完全燃烧,则放出393kJ的热,热量全部由碳燃烧提供,问理论上要消耗碳12g×$\frac{1777000kJ}{393kJ}$=54259.542g,
故答案为:热量全部由碳燃烧提供,问理论上要消耗54259.542g碳.
点评 本题考查反应热有关计算,比较基础,侧重对基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.推理是化学学习中常用的思维方法.下列推理正确的是( )
| A. | 酸能使紫色石蕊溶液变红.通入CO2后的紫色石蕊溶液变红,所以CO2是酸 | |
| B. | 酸性溶液的pH小于7.食醋是酸性溶液,所以食醋的pH小于7 | |
| C. | 在同一化合物中,金属元素显正价,所以非金属元素一定显负价 | |
| D. | 溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小 |
6.对达到平衡状态的下列各可逆反应,加压和降温都能使平衡逆向移动的是( )
| A. | 2NO2(g)═2NO(g)+O2(g)△H>0 | B. | 2 CO(g)═C(s)+CO2(g)△H>0 | ||
| C. | N2(g)+3H2(g)═2NH3(g)△H<0 | D. | 2O3(g)═3O2(g)△H<0 |
3.下列有关叙述正确的是( )
| A. | 任何晶体中,若含有阳离子也一定含有阴离子 | |
| B. | 在电子云示意图中,小黑点密集表示电子在核外空间单位体积内电子出现的机会多 | |
| C. | 强电解质溶液一定比弱电解质溶液的导电能力强 | |
| D. | 常用原子光谱进行有机物相对分子质量的测定 |
4.常温下,有关物质的溶度积如表所示.
下列有关说法不正确的是( )
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
| A. | 常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好 | |
| B. | 常温下,除去NaCl溶液中的CaCl2杂质,选用Na2CO3溶液比NaOH溶液效果好 | |
| C. | 向含有Mg2+,Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.125×1021 | |
| D. | 无法利用Ca(OH)2制备NaOH |
18.铜和其化合物是中学化学的重要学习内容.
(1)自然界中各种原生铜的硫化物经氧化、淋滤作用后转化为硫酸铜溶液,并向溶部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),慢慢地转变为铜蓝(CuS).
①硫化铜与氧气在淋滤作用下生成硫酸铜,该过程的化学方程式为CuS+2O2 $\frac{\underline{\;一定条件\;}}{\;}$CuSO4.
②渗透到地下深层的硫酸铜溶液遇到闪锌矿发生反应的离子方程式为Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq);请简要说明该反应能发生的原因:在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物.
(2)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜,为了测定辉铜矿样品的纯度,可将样品与过量的酸性高锰酸钾溶液反应,该反应的离子方程式为Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O.
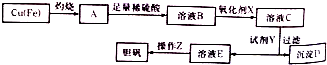
(3)工业上可用多种方法制备硫酸晶体.如图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程图.
已知:
请回答:
①溶液B中含有的阳离子有Fe2+、Fe3+、H +、Cu2(填离子符号),氧化剂X宜选用的物质是H2O2(填化学式);
②加入试剂Y是为了调节pH,试剂Y可以选择的是CuO或CuCO3或Cu(OH)2;
③操作Z的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥等.
④将废铜屑投入到废酸(含硝酸、硫酸)中可以制备硫酸铜晶体,若某100mL废酸混合液中,c(HNO3)=2mol•L-1、c(H2SO4)=4mol•L-1(不含其他酸或氧化剂),则该废酸理论上最多能制备硫酸铜晶体(CuSO4•5H2O)的质量为75g.
⑤现有一块含有铜绿的铜片(假设不含其他杂质)在空气中灼烧可生成氧化铜等物质,经测定,反应前后固体的质量相同,则该铜片中铜的生锈率为34%[已知:金属生锈率=(已生锈的金属质量/金属的总质量)×100%].
(1)自然界中各种原生铜的硫化物经氧化、淋滤作用后转化为硫酸铜溶液,并向溶部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),慢慢地转变为铜蓝(CuS).
①硫化铜与氧气在淋滤作用下生成硫酸铜,该过程的化学方程式为CuS+2O2 $\frac{\underline{\;一定条件\;}}{\;}$CuSO4.
②渗透到地下深层的硫酸铜溶液遇到闪锌矿发生反应的离子方程式为Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq);请简要说明该反应能发生的原因:在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物.
(2)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜,为了测定辉铜矿样品的纯度,可将样品与过量的酸性高锰酸钾溶液反应,该反应的离子方程式为Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O.
(3)工业上可用多种方法制备硫酸晶体.如图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程图.

已知:
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
①溶液B中含有的阳离子有Fe2+、Fe3+、H +、Cu2(填离子符号),氧化剂X宜选用的物质是H2O2(填化学式);
②加入试剂Y是为了调节pH,试剂Y可以选择的是CuO或CuCO3或Cu(OH)2;
③操作Z的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥等.
④将废铜屑投入到废酸(含硝酸、硫酸)中可以制备硫酸铜晶体,若某100mL废酸混合液中,c(HNO3)=2mol•L-1、c(H2SO4)=4mol•L-1(不含其他酸或氧化剂),则该废酸理论上最多能制备硫酸铜晶体(CuSO4•5H2O)的质量为75g.
⑤现有一块含有铜绿的铜片(假设不含其他杂质)在空气中灼烧可生成氧化铜等物质,经测定,反应前后固体的质量相同,则该铜片中铜的生锈率为34%[已知:金属生锈率=(已生锈的金属质量/金属的总质量)×100%].