题目内容
4.工业上,向500-600℃的铁屑中通入氯气生产无水氯化铁(氯化铁遇水能反应);向炽热铁屑中通入氯化氢生产无水氯化亚铁.现用如图所示的装置模拟上述过程进行试验.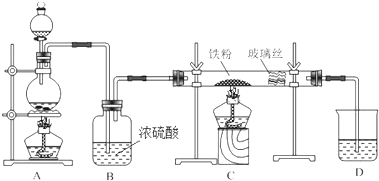
回答下列问题:
(1)检验该装置气密性的方法关闭分液漏斗的活塞,D中导管插入水中,用酒精灯微热烧瓶,D中导管口有气泡冒出,停止加热后,导管内有一段上升的水柱,证明装置气密性良好
(2)制取无水氯化铁的实验中,A中反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+2H2O+Cl2↑该反应的氧化剂为MnO2,氧化产物为Cl2.生成标况下11.2L Cl2时,转移的电子数为6.02×1023.
(3)制取无水氯化亚铁的实验中,装置A用来制取HCl.
(4)该装置制取氯化铁时,存在两点明显缺陷,分别是A与B之间缺少一个除去氯化氢的装置;C和D之间缺少一个干燥装置.
分析 由题给信息可知,题中装置可用于制备氯化铁或氯化亚铁,如制备氯化亚铁,A用于制备HCl,B为干燥装置,在C中生成氯化亚铁,D为尾气处理装置,如制备氯化铁,A用于制备氯气,应先分别除去HCl、水后再在C中生成氯化铁,且C、D之间添加干燥装置,防止氯化铁水解,D为尾气处理装置,以此解答该题.
解答 解:(1)检验该装置气密性的方法:关闭分液漏斗的活塞,D总导气管插入水中,用酒精灯微热烧瓶,D中导气管口有气泡冒出,停止加热后,导气管内有一段上升的水柱,证明装置的气密性良好;
故答案为:关闭分液漏斗的活塞,D中导管插入水中,用酒精灯微热烧瓶,D中导管口有气泡冒出,停止加热后,导管内有一段上升的水柱,证明装置气密性良好;
(2)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,反应中二氧化锰中的锰元素化合价降低,所以二氧化锰为氧化剂,氯化氢中氯元素部分化合价升高到氯气中的0价,部分氯元素化合价不变,所以盐酸在反应中表现为酸性和还原性,对应产物氯气为氧化产物,生成标况下11.2L Cl2,即0.5mol氯气,则转移1mol电子,转移的电子数为6.02×1023,
故答案为:MnO2;Cl2;6.02×1023;
(3)由题给信息可知制取无水氯化亚铁的实验中,装置A用来制取HCl,故答案为:HCl;
(4)如制备氯化铁,A用于制备氯气,应先分别除去HCl、水后再在C中生成氯化铁,且C、D之间添加干燥装置,防止氯化铁水解,
故答案为:A与B之间缺少一个除去氯化氢的装置;C和D之间缺少一个干燥装置.
点评 本题以氯化铁以及氯化亚铁的制取为载体,为高考常见题型,侧重于学生的分析、实验能力的考查,考查的是实验室中氯气的制取方法、常见尾气的处理方法,明确氯气制备原理和性质是解题关键,题目难度中等.

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案| 选项 | 目标物质和杂质 | 检验方法 | 除杂方法 |
| A | FeCl2(FeCl3) | 滴入KSCN | 通入过量氯气 |
| B | NaCl(NH4Cl) | 加热 | 加热 |
| C | KNO3(NaCl) | 焰色反应(透过蓝色钴玻璃) | 重结晶 |
| D | Cl2(HCl) | 通入AgNO3溶液 | 通入饱和NaCl溶液中 |
| A. | A | B. | B | C. | C | D. | D |
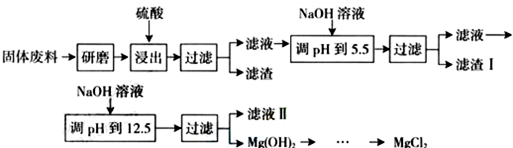
部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下表,请回答下列问题:
| 沉淀物 | Fe3+ | Al3+ | Mg2+ |
| pH | 3.2 | 5.2 | 12.4 |
(2)滤渣I的主要成分有Fe(OH)3、Al(OH)3.
(3)从滤液Ⅱ中可回收利用的主要物质有Na2SO4.
(4)若将MgCl2溶液加热蒸干得到的固体是Mg(OH)2,若要得到MgCl2应采取的操作是在HCl的气流中将MgCl2溶液加热蒸干.
(5)用稀硫酸酸浸时形成滤渣的离子方程式有MgSiO3+2H+=H2SiO3+Mg2+、CaMg(CO3)2+SO42-+4H+=CaSO4+Mg2++2CO2↑+2H2O.
 乙酸和乙醇反应的装置如图所示:在试管里加入3mL乙醇,然后一边搅动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到小试管中溶液的液面上.
乙酸和乙醇反应的装置如图所示:在试管里加入3mL乙醇,然后一边搅动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到小试管中溶液的液面上.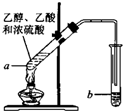 (1)在实验室可使用如图装置制取乙酸乙酯,请回答下列问题:
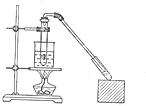
(1)在实验室可使用如图装置制取乙酸乙酯,请回答下列问题: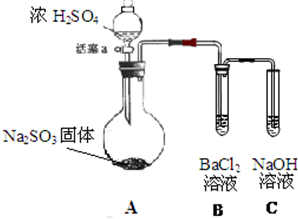 某同学设计了如下实验装置图.(夹持装置和加热装置略,气密性已检验):
某同学设计了如下实验装置图.(夹持装置和加热装置略,气密性已检验):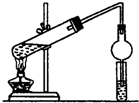 根据题目要求,回答下列问题:
根据题目要求,回答下列问题: CH3COOC2H5+H2O.装置中干燥管的作用是防止倒吸,小试管中的试剂为饱和碳酸钠溶液.
CH3COOC2H5+H2O.装置中干燥管的作用是防止倒吸,小试管中的试剂为饱和碳酸钠溶液.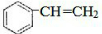 .在一定条件下,A发生聚合反应得到一种高分子化合物,该反应的化学方程式为
.在一定条件下,A发生聚合反应得到一种高分子化合物,该反应的化学方程式为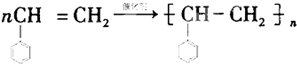 .A与氢气完全加成后产物的一氯代物共有5种.
.A与氢气完全加成后产物的一氯代物共有5种.