题目内容
10.下列说法正确的是( )| A. | “春蚕到死丝方尽,蜡烛成灰泪始干”中的“丝”、“泪”分别是纤维素和油脂 | |
| B. | 乙醇、金属钠和乙酸分别属于非电解质、非电解质和弱电解质 | |
| C. | Na2O2、Al2O3、C4H10分别属于碱性氧化物、两性氧化物和离子化合物 | |
| D. | 煤的气化、石油的分馏分别是化学变化、物理变化 |
分析 A.“丝”、“泪”分别是蛋白质和液态石蜡;
B.非电解质是在熔融状态和水溶液中都不能导电的化合物;
C.碱性氧化物是和酸反应只生成盐和水的氧化物;活泼金属和活泼非金属元素之间易形成离子键,含有离子键的化合物为离子化合物;
D.物理变化与化学变化的区别是否有新物质生成.
解答 解:A.诗句中的“丝”含有的物质是蛋白质,诗句中的“泪”指的是烃,故A错误;
B.乙醇在熔融状态下和水溶液中不能导电,属于非电解质,金属钠是单质,不是非电解质,乙酸在溶液中不能完全电离,属于弱电解质,故B错误;
C.Na2O2不属于碱性氧化物,C4H10不含金属元素,是共价化合物,故C错误;
D.煤的气化是让煤在高温条件下与水蒸气反应生成氢气和一氧化碳,是化学变化,馏是利用物质的沸点不同将物质分离的方法,是物理过程,故D正确.
故选D.
点评 本题考查物质的分类以及物理变化与化学变化的区别等,为高考常见题型和高频考点,难度不大.要注意基础知识的积累.

练习册系列答案
相关题目
2.下列表示对应化学反应的离子方程式.其中正确的是( )
| A. | 向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | NH4HCO3溶液中加入过量氢氧化钠溶液:NH4++OH-═NH3.H2O | |
| C. | AlCl3溶液中滴加过量氨水:Al3++3NH3.H2O═3NH4++Al(OH)3↓ | |
| D. | 磁性氧化铁(Fe3O4)溶于稀硝酸3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
18.高锰酸钾[KMnO4]是常用的氧化剂.工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.中间产物为锰酸钾[K2MnO4].如图1是实验室模拟制备的操作流程:

相关资料:
①物质溶解度
②锰酸钾[K2MnO4]
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚,实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,请用离子方程式表示实验中通入适量CO2时导致体系中KMnO4产品纯度降低的原因:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-;
(3)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.

相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚,实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,请用离子方程式表示实验中通入适量CO2时导致体系中KMnO4产品纯度降低的原因:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-;
(3)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.
5.镍是有机合成的重要催化剂.某化工厂有含镍催化剂废品(主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质).某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:
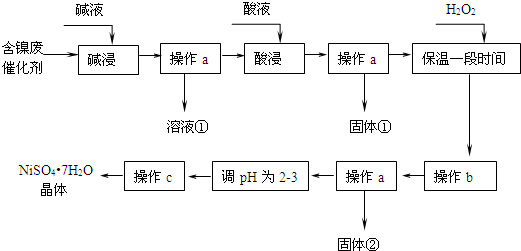
几种难溶碱开始沉淀和完全沉淀的pH:
回答下列问题:
(1)溶液①中含金属元素的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O.双氧水可以用下列物质替代的是A.
A.氧气 B.漂液 C.氯气 D.硝酸
(3)操作b调节溶液范围为3.2-7.1,其目的是除去Fe3+.
(4)操作a和c需要共同的玻璃仪器是玻璃棒.上述流程中,防止浓缩结晶过程中Ni2+水解的措施是调节溶液pH为2-3.
(5)如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是产品中混有绿矾.设计实验证明产品中是否含“杂质”(不考虑硫酸镍影响):取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有Fe2+.

几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(1)溶液①中含金属元素的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O.双氧水可以用下列物质替代的是A.
A.氧气 B.漂液 C.氯气 D.硝酸
(3)操作b调节溶液范围为3.2-7.1,其目的是除去Fe3+.
(4)操作a和c需要共同的玻璃仪器是玻璃棒.上述流程中,防止浓缩结晶过程中Ni2+水解的措施是调节溶液pH为2-3.
(5)如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是产品中混有绿矾.设计实验证明产品中是否含“杂质”(不考虑硫酸镍影响):取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有Fe2+.
15.常温下,下列溶液中有关物质的量浓度关系不正确的是( )
| A. | pH=2的HA溶液与pH=12的MOH溶液等体积混合后pH<7,则HA为弱酸 | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) | |
| C. | 物质的量浓度均为0.2mol•L-1CH3COOH和CH3COONa溶液等体积混合:2c(Na+)=c(CH3COO-)+c(CH3COOH)=0.2mol•L-1 | |
| D. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
2.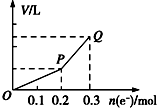 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )| A. | 0.15 mol CuO | B. | 0.1 mol CuCO3 | ||
| C. | 0.075mol Cu(OH)2 | D. | 0.05 mol Cu2(OH)2CO3 |
19.等质量的两份铝粉分别与足量的稀NaOH溶液和稀硫酸反应,若消耗两溶液的体积相等,则两溶液的物质的量浓度之比是( )
| A. | 1:2 | B. | 2:3 | C. | 3:2 | D. | 1:1 |
20.某烯烃的结构简式为 有甲、乙、丙、丁四位同学分别将其命名为:2甲基4乙基4戊烯;2异丁基1丁烯;2,4二甲基3己烯;4甲基2乙基1戊烯,下面对4位同学的命名判断正确的是( )
有甲、乙、丙、丁四位同学分别将其命名为:2甲基4乙基4戊烯;2异丁基1丁烯;2,4二甲基3己烯;4甲基2乙基1戊烯,下面对4位同学的命名判断正确的是( )
 有甲、乙、丙、丁四位同学分别将其命名为:2甲基4乙基4戊烯;2异丁基1丁烯;2,4二甲基3己烯;4甲基2乙基1戊烯,下面对4位同学的命名判断正确的是( )
有甲、乙、丙、丁四位同学分别将其命名为:2甲基4乙基4戊烯;2异丁基1丁烯;2,4二甲基3己烯;4甲基2乙基1戊烯,下面对4位同学的命名判断正确的是( )| A. | 甲的命名中主链选择是错误的 | |
| B. | 乙的命名中对主链碳原子的编号是错误的 | |
| C. | 丙的命名中主链选择是正确的 | |
| D. | 丁的命名是正确的 |
