题目内容
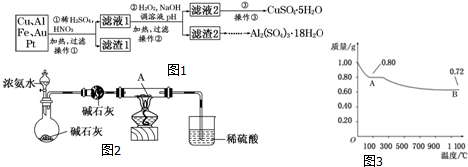
1.过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.工业上生产过氧化钙的主要流程如下:
已知CaO2•8H2O呈白色,微溶于水.I2+2S2O32-=2I-+S4O62-
(1)用上述方法制取CaO2•8H2O的化学方程式是CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4Cl;
(2)检验“水洗”是否合格的方法是取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀;
(3)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c mol•L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.
①判断此滴定实验达到终点的方法是:当滴入最后一滴标准溶液时溶液由蓝色变为无色(或溶液褪色),且半分钟不变色.
②CaO2的质量分数为$\frac{36cV×10{\;}^{-3}}{a}$×100% (用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能偏高(填“不受影响”、“偏低”或“偏高”),原因是在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高.
分析 (1)根据图示流程中找出反应物、生成物,写出反应的化学方程式;
(2)通过检验洗涤液中是否含有氯离子来判断检验“水洗”是否合格;
(3)①根据滴定结束前溶液为蓝色,滴定结束是溶液由蓝色变成无色分析;
②根据电子守恒及化学反应方程式找出过氧化钙与硫代硫酸钠反应的关系式,再根据题中数据计算出样品中过氧化钙的质量分数;
③根据空气中的氧气能够氧化碘离子,使碘单质的量增加,消耗的硫代硫酸钠增加分析.
解答 解:(1)由流程可知,反应物为氯化钙、双氧水、氨气和水,生成为CaO2•8H2O和氯化铵,反应的化学方程式为:CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4Cl,
故答案为:CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4Cl;
(2)检验“水洗”是否合格的方法是:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀,
故答案为:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀;
(3)①在滴定结束之前,溶液的淀粉与碘单质显示蓝色,当碘单质反应完全后,溶液变成无色,所以达到终点现象为:当滴入最后一滴标准溶液时溶液由蓝色变为无色(或溶液褪色),且半分钟不变色,
故答案为:当滴入最后一滴标准溶液时溶液由蓝色变为无色(或溶液褪色),且半分钟不变色;
②过氧化钙氧化碘化钾生成的碘单质,用硫代硫酸钠滴定时,消耗的硫代硫酸钠的物质的量为:cmol•L-1×V×10-3L=cV×10-3mol,根据氧化还原反应中电子守恒及题中反应方程式可得关系式:CaO2~I2~2S2O32-,过氧化钙的物质的量为:n(CaO2)=$\frac{1}{2}$n(S2O32-)=$\frac{1}{2}$×cV×10-3mol,
样品中CaO2的质量分数为:$\frac{\frac{1}{2}×cV×10{\;}^{-3}mol×72g/mol}{ag}$×100%=$\frac{36cV×10{\;}^{-3}}{a}$×100%,
故答案为:$\frac{36cV×10{\;}^{-3}}{a}$×100%;
③在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高,
故答案为:偏高;在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高.
点评 本题考查形式为物质制备流程图题目,涉及中和滴定中的误差分析、物质的检验及化学计算等问题,题目难度较大,做题时注意分析题中关键信息、明确实验基本操作方法,本题较为综合,充分考查了学生的分析、化学实验、化学计算能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案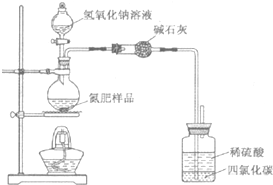 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:氢氧化钠少量时2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH=Na2SO4+NH3↑+2H2O
(1)同学们设计的实验装置图如下,请回答相关问题.
①装置中碱石灰的作用是吸收氨气中的水蒸气.
②广口瓶内四氯化碳的作用是防止倒吸.
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是残留在反应装置中的氨气未被稀硫酸吸收.
(2)同学们改进实验装置后(改进装置图略),进行如下实验.称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量.部分实验数据如下:
| 氢氧化钠溶液/mL | 40.00 | ||
| 样品质量/g | 7.750 | 15.50 | 23.25 |
| 氨气质量/g | 1.870 | 1.870 | 1.700 |
①样品中氮元素的质量分数是19.87%.
②所用氢氧化钠溶液的物质的量浓度为3.25 mol/L.
③若样品质量为31.00g,则生成氨气的质量为1.53 g.
| A. | 硫原子的原子结构示意图: | |
| B. | NH4Cl的电子式: | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 乙烯的最简式为CH3 |
(一)制备苯甲酸乙酯
 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O相关物质的部分物理性质如表格:
| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环己烷、乙醇和水共沸物 | 62.1 |

(1)制备苯甲酸乙酯,图2装置最合适的是B,反应液中的环己烷在本实验中的作用(通过形成水-乙醇-环己烷三元共沸物)带出生成的水,促进酯化反应向正向进行.

(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.
反应完成的标志是分水器中下层(水层)液面不再升高.
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸,碳酸钠固体需搅拌下分批加入的原因加入过快大量泡沫的产生可使液体溢出.
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用萃取出水层中溶解的苯甲酸乙酯,提高产率.
(5)步骤⑤蒸馏操作中,图3装置最好的是bd(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热、油浴加热).

(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
(6)混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应,趁热过滤的原因苯甲酸铜冷却后会结晶析出,如不趁热过滤会损失产品
(7)本实验中下列药品不能代替氢氧化铜使用的是D
A.醋酸铜 B.氧化铜 C.碱式碳酸铜 D.硫酸铜
(8)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是C
A.冷水 B.热水 C.乙醇 D.乙醇水混合溶液.
| A. | “春蚕到死丝方尽,蜡烛成灰泪始干”中的“丝”、“泪”分别是纤维素和油脂 | |
| B. | 乙醇、金属钠和乙酸分别属于非电解质、非电解质和弱电解质 | |
| C. | Na2O2、Al2O3、C4H10分别属于碱性氧化物、两性氧化物和离子化合物 | |
| D. | 煤的气化、石油的分馏分别是化学变化、物理变化 |
 已知①A是一种分子量为28的气态烃,②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.请回答下列问题:
已知①A是一种分子量为28的气态烃,②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.请回答下列问题: ,B分子中的官能团名称羟基.
,B分子中的官能团名称羟基. .
.
 .
. .
. .
.