题目内容
8. 氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.(1)已知:N2(g)+2H2(g)=N2H4(l)△H=+50.6kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-622.2kJ•mol-1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是△H>0,△S<0.
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是NaClO+2NH3=N2H4+NaCl+H2O.
(2)采矿废液中的CN- 可用H2O2处理.已知:H2SO4=H++HSO4- HSO4-?H++SO42-
用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82-,S2O82-水解可以得到H2O2.写出阳极上的电极反应式2HSO4--2e-═S2O82-+2H+.
(3)氧化镁处理含NH4+的废水会发生如下反应:
MgO+H2O?Mg(OH)2 Mg(OH)2+2NH4+?Mg2++2NH3•H2O.
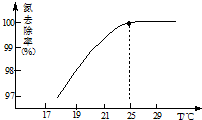
①温度对氮处理率的影响如图所示.在25℃前,升高
温度氮去除率增大的原因是升高温度NH3的溶解度降低,有利于NH3的逸出.
②剩余的氧化镁,不会对废水形成二次污染,理由是氧化镁难溶于水中,以沉淀的形式排出,因此不会形成二次污染.
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下:
①取10mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175mL
②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热
③用25mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3=(NH4)2B4O7+5H2O]
④将吸收液移至锥形瓶中,加入2滴指示剂,用c mol•L-1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O=(NH4)2SO4+4H3BO3],记录消耗的体积V mL.
则水样中氮的含量是2800cVmg•L-1(用含c、V的表达式表示).(请写出计算过程)
分析 (1)①a、N2(g)+2H2(g)═N2H4(l);△H=+50.6kJ•mol-1
b、2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ•mol-1
依据盖斯定律b-a得到N2H4(l)+O2(g)═N2(g)+2H2O(l);依据热化学方程式和盖斯定律来计算;
②依据△H-T△S<0判断反应自发进行;
③用次氯酸钠氧化氨,可以得到N2H4和氯化钠,据此书写方程式;
(2)电解池中阴离子在阳极失电子发生氧化反应;
(3)①依据氨气溶解度随温度增大减小分析;
②氧化镁是难溶物质;
(4)依据滴定实验步骤和滴定用量结合化学方程式计算分析得到.
解答 解:(1)①a、N2(g)+2H2(g)═N2H4(l);△H=+50.6kJ•mol-1
b、2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ•mol-1
依据盖斯定律b-a得到N2H4(l)+O2(g)═N2(g)+2H2O(l);△H=-622.2KJ/mol,
故答案为:-622.2;
②N2(g)+2H2(g)═N2H4(l)不能自发进行的原因是△H-T△S>0,则反应△S<0,△H>0,故答案为:△H>0,△S<0;
③用次氯酸钠氧化氨,可以得到N2H4和氯化钠,方程式为:NaClO+2NH3=N2H4+NaCl+H2O,故答案为:NaClO+2NH3=N2H4+NaCl+H2O;
(2)用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82-,HSO4-离子在阳极失电子生成S2O82-,电极反应为:2HSO4--2e-═S2O82-+2H+,
故答案为:2HSO4--2e-═S2O82-+2H+;
(3)①在25℃前,升高温度氮去除率增大的原因是因为氨气溶解度随温度升高,溶解度减小,
故答案为:升高温度NH3的溶解度降低,有利于NH3的逸出;
②剩余的氧化镁,是难溶于水的物质沉淀出不形成污染,不会对废水形成二次污染,
故答案为:氧化镁难溶于水中,以沉淀的形式排出,因此不会形成二次污染;
(4)依据滴定实验和反应化学方程式可知:
2NH3~(NH4)2B4O7~H2SO4
2 1
2×cV×10-3mol cV×10-3mol
水样中氮的含量=$\frac{2cV×1{0}^{-3}mol×14g/mol}{0.01L}$=2.8cV(g/L)=2800cV(mg/L),
故答案为:2800cV.
点评 本题考查了热化学方程式和盖斯定律计算应用,电极原理的分析判断电极书写,实验过程分析理解,滴定实验的计算应用,题目难度中等.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案①易溶于乙醇和水,微溶于乙醚(易挥发),难溶于苯和四氯化碳.
②草酸具有很强的还原性

请跟据以上信息回答下列问题:
(1)氧化-水解过程是在上图1的装置中进行的,指出装置A的名称三颈烧瓶.
(2)氧化-水解过程中,在硝酸用量、反应的时间等条件均相同的情况下,改变反应温度以考察反应温度对草酸产率的影响,结果如图2所示,请选择最佳的反应温度为70℃,实验中若混酸滴加过快或温度过高,将导致草酸产率下降,其原因是草酸易被浓硫酸或硝酸氧化.
(3)得到粗产品后,洗涤时选择乙醚 作洗涤剂,理由是易挥发,无残留.
(4)为了确定产品中H2C2O4•2H2O(M=126g/mol)的纯度,称取10.0g草酸样品,配成250mL溶液,每次实验时准确量取25.00mL草酸溶液,加入适量的稀硫酸,用0.1mol/LKMnO4标准溶液滴定.平行滴定三次,重复滴定三次,每次消耗KMnO4标准溶液的体积如表所示
| 第一次 | 第二次 | 第三次 | |
| 体积(mL) | 16.10mL | 16.60mL | 15.90mL |
②在草酸纯度测定的实验过程中,下列说法正确的是:CD.
A.配制标准液时,若KMnO4不纯(杂质不与待测液反应),会使实验误差偏低
B.润洗滴定管时,应从滴定管上口加满所需的酸或碱液,使滴定管内壁充分润洗
C.滴定时,眼睛注视锥形瓶,观察溶液颜色变化
D.滴定终点读取滴定管刻度时,仰视标准液液面,会使实验误差偏高
③判断滴定已经达到终点的方法是:锥形瓶中滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红色且半分钟后不变色.
④草酸晶体的纯度为50.4%.
| A. | Cl- NO3- Ba2+ Fe3+ | B. | SO42- S2- Al3+ Mg2+ | ||
| C. | Na+ K+ SO42- Cl- | D. | NH4+ Ba2+ Cl- HCO3- |
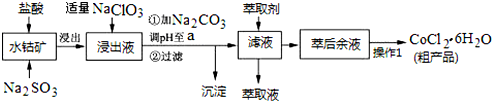
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
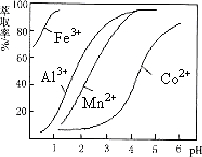
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
| A. | 质子数和中子数均为6的碳原子:${\;}_{6}^{6}C$ | |
| B. | 硫离子的结构示意图: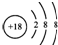 | |
| C. | 氢氧化钠的电子式: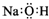 | |
| D. | 2-丙醇的结构简式: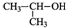 |
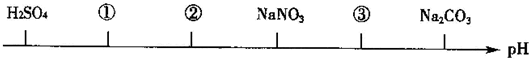
| A. | CuCl2 CH3COOH NaOH | B. | HCl H2SO3 NaHCO3 | ||
| C. | HF HCl CH3COONa | D. | NH4Cl HCl CH3COONa |
| A. | C10H8和C6H8O3 | B. | C2H2和C6H6 | C. | C2H4和C3H6 | D. | CH4和C2H4 |