题目内容
4.某同学查阅资料得:H2在的热值为143kJ/g,写出表示H2标准燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286 kJ•mol-1,常温下分解27g水至少需要的能量为429 kJ.
分析 根据燃烧热的含义:完全燃烧1mol物质生成最稳定的化合物所放出的热以及热化学方程式的书写方法来回答.
解答 (1)H2的热值为143kJ/g,即燃烧1g氢气会释放143kJ的能量,据热化学方程式的含义,H2的标准燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol,
所以1mol液态水分解应该吸收286kJ的能量,常温下分解27g即1.5mol水至少需要的能量为1.5mol×286kJ/mol
=429 kJ,故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol;429kJ.
点评 本题考查学生燃烧热的意义以及热化学方程式的书写和计算等知识,属于基本知识的考查,难度中等.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
17.溴化碘(IBr)是一种卤素互化物,它的化学性质活泼,能与大多数金属反应,也能与某些分金属单质反应,并能与水发生如下反应:IBr+H2O→HBr+HIO,下列有关溴化碘的叙述不正确的是( )
| A. | 溴化碘与Br2、I2具有相似的化学性质 | |
| B. | 在许多反应中,IBr是一种强氧化剂 | |
| C. | 在溴化碘与水反应中,IBr既是氧化剂,又是还原剂 | |
| D. | 溴化碘与氢氧化钠溶液反应时可生成两种盐 |
19.下列有关说法正确的是( )
| A. | 在同温同压下,相同体积的任何气体含有相同数目的原子 | |
| B. | 氧化还原反应的本质是有电子转移 | |
| C. | Na2SO4溶液在电流作用下电离出Na+与SO42-而导电 | |
| D. | NaCl固体不导电,所以NaCl不是电解质 |
9.下列电离方程式正确的是( )
| A. | H2SO4═2H++SO${\;}_{4}^{2-}$ | B. | H3PO4?3H++PO${\;}_{4}^{3-}$ | ||
| C. | NaHCO3═Na++H++CO${\;}_{3}^{2-}$ | D. | CaCO3?Ca2++CO${\;}_{3}^{2-}$ |
14.常温下,下列各组离子在特定溶液中一定能大量共存的是( )
| A. | 由水电离出的c(H+)=10-12 mol•L-1的溶液中:Na+、Cl-、HCO3-、SO42- | |
| B. | pH=12的澄清的溶液中:K+、Na+、MnO4-、SO42- | |
| C. | 甲基橙呈红色的溶液中:NH4+、Ba2+、AlO2-、Cl- | |
| D. | 加入少量铝粉后能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42- |
 ,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.
,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.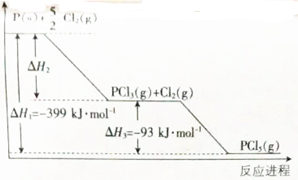

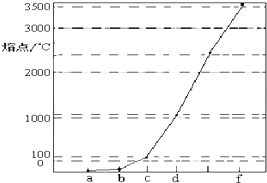
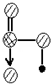 请简要说明该物质易溶于水的原因
请简要说明该物质易溶于水的原因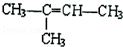 的名称是2-甲基-2-丁烯
的名称是2-甲基-2-丁烯 .
.