题目内容
17.有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子:(每种物质只含一种阳离子和一种阴离子且互不重复)阳离子:K+、Na+、Ba2+、NH${\;}_{4}^{+}$
阴离子:AlO${\;}_{2}^{-}$、Cl-、OH-、SO${\;}_{4}^{2-}$
已知:A、C溶液呈碱性,浓度相同时C溶液pH大,B溶液呈酸性,D溶液焰色反应呈黄色;C溶液和D溶液相遇时生成白色沉淀,A、B的浓溶液混合时既有白色沉淀,又有刺激性气味的气体生成.
(1)A的化学式是KAlO2;
(2)用离子方程式表示B溶液显酸性的原因NH4++H2O?NH3•H2O+H+;
(3)写出A溶液和B溶液反应的离子方程式:NH4++AlO2-+H2O═Al(OH)3↓+NH3↑;
(4)25℃时pH=10的A溶液中水的电离程度>pH=10的C溶液中水的电离程度(填写“>”、“<”、“=”);
(5)25℃时在一定体积0.1mol•L-1C溶液中,加入一定体积的0.1mol•L-1 盐酸时,混合溶液pH=13,则C溶液与盐酸的体积比是2:1;(溶液混合时体积变化忽略不计)
(6)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
分析 由D溶液焰色反应呈黄色,D中含钠离子,B溶液呈酸性,B中含硫酸根离子,由A、C溶液呈碱性,浓度相同时C溶液pH大,则A为KAlO2,C为Ba(OH)2,C溶液和D溶液相遇时生成白色沉淀,则D为Na2SO4,A、B的浓溶液混合时既有白色沉淀,又有刺激性气味的气体生成,B为NH4Cl,A、B相互促进水解生成氢氧化铝沉淀和氨气,以此来解答.
解答 解:由D溶液焰色反应呈黄色,D中含钠离子,B溶液呈酸性,B中含硫酸根离子,由A、C溶液呈碱性,浓度相同时C溶液pH大,则A为KAlO2,C为Ba(OH)2,C溶液和D溶液相遇时生成白色沉淀,则D为Na2SO4,A、B的浓溶液混合时既有白色沉淀,又有刺激性气味的气体生成,B为NH4Cl,A、B相互促进水解生成氢氧化铝沉淀和氨气,
(1)由上述分析可知A为KAlO2,故答案为:KAlO2;
(2)B为硫酸铵,铵根离子水解显酸性,水解离子反应为NH4++H2O?NH3•H2O+H+,故答案为:NH4++H2O?NH3•H2O+H+;
(3)A溶液和B溶液反应的离子方程式为NH4++AlO2-+H2O═Al(OH)3↓+NH3↑,故答案为:NH4++AlO2-+H2O═Al(OH)3↓+NH3↑;
(4)A水解促进水的电离,而C为强碱,抑制水的电离,则25℃时pH=10的A溶液中水的电离程度>pH=10的C溶液中水的电离程度,故答案为:>;
(5)混合溶液pH=13,则碱过量,设C溶液与盐酸的体积分别为x、y,则$\frac{x×0.1mol/L×2-y×0.1mol/L}{x+y}$=0.1,解得x:y=2:1,故答案为:2:1;
(6)将等体积、等物质的量浓度的B溶液和C溶液混合,物质的量相同,设NH4Cl、Ba(OH)2均为1mol,n(OH-)在1~2mol之间,n(Ba2+)=n(Cl-)=1mol,n(NH4+)略小于1mol,溶液显碱性n(H+)最小,则离子浓度大小为c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+),
故答案为:c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
点评 本题考查无机物的推断,为高频考点,把握物质的性质、盐类水解、pH的计算等为解答的关键,侧重分析、计算及推断能力的考查,注意反应原理的综合应用,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 结构式:H2-C=C-H2 | B. | 最简式:CH2 | ||
| C. | 分子式:C2H4 | D. | 电子式: |
| A. | 含有大量Ba2+的溶液中:HCO3-、Fe3+、Na+、SCN- | |
| B. | 由水电离的c(OH-)=10-14mol•L-1 的溶液中:S2-、Cl-、Na+、K+ | |
| C. | 滴加无色酚酞试液后仍无色的溶液中:Na+、CO32-、K+、ClO-、AlO2- | |
| D. | 加入铝粉后产生氢气的溶液中:NH4+、Na+、NO3-、Cl-、S2- |
 最多可能有多少个碳原子共面( )
最多可能有多少个碳原子共面( )| A. | 12 | B. | 11 | C. | 10 | D. | 9 |
| A. | 239Pu原子的原子核中含有239个质子 | |
| B. | 238Pu、239Pu和241Pu属于不同的核素 | |
| C. | 238Pu与238U在元素周期表中的位置相同 | |
| D. | 239Pu衰变成235U属于化学变化 |
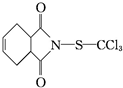 )是一种广谱性的主要用于叶面保护的杀菌剂,无药害,在果树、蔬菜及各种经济作物上使用.下列说法正确的是( )
)是一种广谱性的主要用于叶面保护的杀菌剂,无药害,在果树、蔬菜及各种经济作物上使用.下列说法正确的是( )| A. | 克菌丹的分子式为C9H8O2NSCl3,属于芳香族化合物 | |
| B. | 克菌丹易溶于水,在加热条件下不能与NaOH溶液反应 | |
| C. | 克菌丹能与溴的CCl4溶液发生取代反应使之褪色 | |
| D. | 克菌丹在一定条件下能发生取代、加聚等反应 |
 光伏产业作为我国战略性新兴产业之一,多晶硅是重要原料.
光伏产业作为我国战略性新兴产业之一,多晶硅是重要原料.