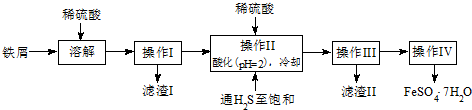
题目内容
5.常温下的两瓶醋酸溶液,第一瓶醋酸溶液的浓度为C1,第二瓶醋酸溶液的浓度为C2,第二瓶醋酸溶液中醋酸根离子的浓度恰好为C1,则必然有( )| A. | C1>C2 | |
| B. | 两瓶溶液的导电能力相同 | |
| C. | 第一瓶溶液的pH大于第二瓶溶液的pH | |
| D. | 第一瓶溶液中醋酸的电离程度小于第二瓶溶液中醋酸的电离程度 |
分析 常温下的两瓶醋酸溶液,第一瓶醋酸溶液的浓度为C1,第二瓶醋酸溶液的浓度为C2,第二瓶醋酸溶液中醋酸根离子的浓度恰好为C1,由于醋酸为弱酸,则C2>C1;醋酸的浓度越大,醋酸的电离程度越小;溶液中离子浓度越大,溶液导电性越强;氢离子浓度越大,溶液的pH越小,据此进行解答.
解答 解:常温下的两瓶醋酸溶液,第一瓶醋酸溶液的浓度为C1,第二瓶醋酸溶液的浓度为C2,第二瓶醋酸溶液中醋酸根离子的浓度恰好为C1,由于醋酸为弱酸,则C2>C1,
A.根据分析可知,C2>C1,故A错误;
B.溶液中离子浓度越大,溶液的导电能力越强,第一瓶醋酸溶液中醋酸根离子浓度小于C1,第二瓶醋酸溶液中醋酸根离子的浓度恰好为C1,显然第二瓶中溶液的导电能力更强,故B错误;
C.根据B可知,第一瓶醋酸中醋酸根离子浓度小于第二瓶,则第一瓶溶液中的氢离子浓度较小,其溶液的pH较大,即:第一瓶溶液的pH大于第二瓶溶液的pH,故C正确;
D.醋酸的浓度越大,醋酸的电离程度越小,由于C2>C1,则第一瓶醋酸的电离程度大于第二瓶,故D错误;
故选C.
点评 本题考查了弱电解质在水溶液中的电离平衡,题目难度中等,明确电离平衡及其影响为解答关键,注意弱电解质的浓度越大,其电离程度越小,为易错点,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
15.下列物质中,不能使品红溶液褪色的是( )
| A. | 次氯酸 | B. | 臭氧 | C. | 二氧化碳 | D. | 二氧化硫 |
16.元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语.下列有关化学用语的表示方法中正确的是( )
| A. | H2O2的电子式: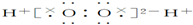 | |
| B. | NH4I的电子式: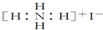 | |
| C. | 原子核内有10个中子的氧原子:1810O | |
| D. | CO2分子的结构式:O═C═O |
13.同一主族的两种元素的核外电子差值不可能为( )
| A. | 2 | B. | 8 | C. | 18 | D. | 30 |
10.将木炭与浓硫酸共热后得到的过量气体通入下列溶液中不会得到无色澄清溶液的是( )
| A. | 稀品红溶液 | B. | Ca(OH)2溶液 | C. | 溴水 | D. | 饱和H2S溶液 |
17.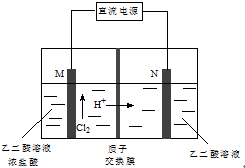 乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法正确的是( )
乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法正确的是( )
 乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法正确的是( )
乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法正确的是( )| A. | M极与直流电源的负极相连 | |
| B. | 若有2 molH+通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1 mol | |
| C. | N电极上的电极反应式:HOOC-COOH-2e-+2H+=HOOC-CHO+H2O | |
| D. | 乙二醛与M电极的产物反应生成乙醛酸的化学方程式:Cl2+OHC-CHO+H2O=HOOC-CHO+2HCl |