题目内容
17. 没食子儿茶素的结构如图所示,关于该物质下列叙述中正确的是( )
没食子儿茶素的结构如图所示,关于该物质下列叙述中正确的是( )| A. | 分子式为C15H12O5 | |
| B. | 遇FeCl3溶液不发生显色反应 | |
| C. | 1mol该物质与4molNaOH恰好完全反应 | |
| D. | 易发生氧化反应和取代反应,难发生加成反应 |
分析 由结构可知分子式,分子中含酚-OH、醇-OH及醚键,结合酚、醇的性质来解答.
解答 解:A.由结构可知分子式为C15H14O5,故A错误;
B.含酚-OH,遇FeCl3溶液发生显色反应,故B错误;
C.只有酚-OH与NaOH反应,则1mol该物质与3molNaOH恰好完全反应,故B错误;
D.含-OH可发生氧化反应和取代反应,含苯环可在催化剂条件下发生加成反应,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意酚与醇的性质,题目难度不大.

练习册系列答案
相关题目
7.已知:相关物质的溶度积常数见表:
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2•2H2O晶体,按如图步骤进行提纯:

(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反
应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.(I2+2S2O32-═S4O62-+2I-)
①可选用淀粉溶液作滴定指示剂.②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |

(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反
应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.(I2+2S2O32-═S4O62-+2I-)
①可选用淀粉溶液作滴定指示剂.②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.
8.当光束通过下列分散系时,能产生丁达尔效应的是( )
| A. | NaCl溶液 | B. | Fe(OH)3胶体 | C. | 浓硫酸 | D. | 泥浆 |
5.生活中很多现象都涉及能量的转化.下列反应中属于吸热反应是( )
| A. | 煅烧石灰石 | B. | 炸药爆炸 | ||
| C. | 食物因氧化而腐败 | D. | 石灰水中和酸性土壤 |
12.下列叙述不正确的是( )
| A. | H2S、H2O、HF 的稳定性依次增强 | |
| B. | RbOH、KOH、Ca(OH)2的碱性依次减弱 | |
| C. | Na、Mg、Al 的还原性依次增强 | |
| D. | H4SiO4、H2CO3、H2SO4的酸性依次增强 |
2.下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S ②离子半径:F->Na+>Mg2+>Al3+
③酸性:H3PO4>H2SO4>HClO4④结合质子能力:OH->CH3COO->Cl-( )
①热稳定性:H2O>HF>H2S ②离子半径:F->Na+>Mg2+>Al3+
③酸性:H3PO4>H2SO4>HClO4④结合质子能力:OH->CH3COO->Cl-( )
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
9.用下列方法:①KMnO4受热分解;②KClO3受热分解(用MnO2作催化剂);
③2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ ④2Na2O2+2H2O═4NaOH+O2↑,若要制得相同质量的氧气,上述四种方法中所转移的电子数目之比是( )
③2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ ④2Na2O2+2H2O═4NaOH+O2↑,若要制得相同质量的氧气,上述四种方法中所转移的电子数目之比是( )
| A. | 3:2:1:4 | B. | 1:1:1:1 | C. | 1:2:1:2 | D. | 2:2:1:1 |
6.科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )
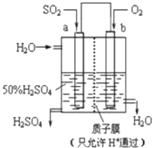

| A. | a为正极,b为负极 | |
| B. | 生产过程中H+向a电极区域运动 | |
| C. | 电子从b极向a极移动 | |
| D. | 负极反应式为:2H2+SO2-2e-=SO42-+4H+ |
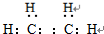 ,B的结构简式
,B的结构简式 或
或 .
.