题目内容
11.Na2CO3溶液中离子浓度大小顺序为:c(Na+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+).分析 Na2CO3为强碱弱酸盐,水解呈碱性,在溶液中存在CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,且以第一步为主,据此分析离子浓度大小关系.
解答 解:Na2CO3为强碱弱酸盐,水解呈碱性,在溶液中存在CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,因CO32-水解水解显碱性,且第一步水解大于第一步电离,则离子浓度关系为:c(Na+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+),
故答案为:c(Na+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+).
点评 本题考查了盐类水解,根据“谁强谁显性、谁弱谁水解”来确定溶液酸碱性,再结合电荷守恒判断离子浓度大小,题目难度不大.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
19.下列各组离子一定能大量共存的是( )
| A. | 在无色溶液中:NH4+、Fe2+、SO42-、CO32- | |
| B. | 在含大量Fe3+溶液中:NH4+、Na+、Cl-、SCN- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、SO32- | |
| D. | 使石蕊变红色的溶液中:K+、Fe2+、Cl-、CH3COO- |
6.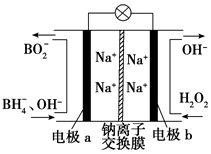 据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
 据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )| A. | 每消耗1 mol H2O2,转移的电子为1 mol | |
| B. | 电极b采用MnO2,MnO2既作电极材料又有催化作用 | |
| C. | 该电池的正极反应为BH4-+8OH--8e-═BO2-+6H2O | |
| D. | 电池放电时Na+从b极区移向a极区 |
16.下列物质中属于非电解质的是( )
| A. | NaHCO3 | B. | Cl2 | C. | HNO3 | D. | CO2 |
3.下列对Na2CO3的分类,不正确的是( )
| A. | Na2CO3是有机物 | B. | Na2CO3是碳酸盐 | ||
| C. | Na2CO3是钠盐 | D. | Na2CO3是易溶性盐 |
20.下列关于元素周期表的叙述中正确的是 ( )
| A. | 元素周期表有7个周期和18个族 | |
| B. | 由短周期元素和长周期元素共同组成的族一定是主族 | |
| C. | 从左向右数第13列是第ⅢB族 | |
| D. | 元素周期表中0族元素的单质全部是气体 |
1.下列有关说法不正确的是( )
| A. | 溴化银是一种重要的感光材料,是胶卷中的核心成分之一 | |
| B. | 硅晶体是一种重要的半导体材料,还可用于制造光导纤维 | |
| C. | 镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 | |
| D. | 硫酸钡不容易被X射线透过,在医疗上可用作检查肠胃的内服药剂 |
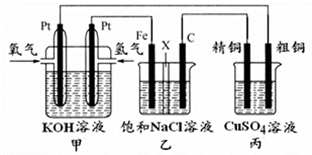 某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.
某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.