题目内容
用碳棒作电极,在H+、Na+、Cu2+、Ag+、Cl-、NO3-、SO42-等离子中选出适当离子组成电解质,电解其溶液:
(1)当阴极放出H2,阳极放出O2时,电解质的化学式是 ;
(2)当阴极析出金属,阳极放出O2时,电解质的化学式是 ;
(3)当阴极放出H2,阳极放出Cl2时,电解质的化学式是 ;
(4)电解过程中电解质和水都减少时,电解质的化学式是 .
(1)当阴极放出H2,阳极放出O2时,电解质的化学式是
(2)当阴极析出金属,阳极放出O2时,电解质的化学式是
(3)当阴极放出H2,阳极放出Cl2时,电解质的化学式是
(4)电解过程中电解质和水都减少时,电解质的化学式是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:阴极上阳离子放电顺序为Ag+>Cu2+>H+>Na+,阳极上阴离子放电顺序为Cl->OH->SO42-、NO3-,
(1)当阴极放出H2,阳极放出O2时,则溶液中的电解质不放电,根据离子的放电顺序分析;
(2)当阴极析出金属,则金属离子为Cu2+或Ag+,阳极放出O2时,阴离子为SO42-或NO3-;
(3)当阴极放出H2,则阴极为H+放电,阳极放出Cl2阴离子为Cl-放电;
(4)电解过程中电解质和水都减少时,如阳极生成氧气,则阴极析出金属,如阴极析出氢气,则阳极应生成氯气.
(1)当阴极放出H2,阳极放出O2时,则溶液中的电解质不放电,根据离子的放电顺序分析;
(2)当阴极析出金属,则金属离子为Cu2+或Ag+,阳极放出O2时,阴离子为SO42-或NO3-;
(3)当阴极放出H2,则阴极为H+放电,阳极放出Cl2阴离子为Cl-放电;
(4)电解过程中电解质和水都减少时,如阳极生成氧气,则阴极析出金属,如阴极析出氢气,则阳极应生成氯气.
解答:
解:阴极上阳离子放电顺序为Ag+>Cu2+>H+>Na+,阳极上阴离子放电顺序为Cl->OH->SO42-、NO3-,
(1)当阴极放出H2,阳极放出O2时,则溶液中的电解质不放电,溶液中阳离子为H+或Na+,阴离子为OH-或SO42-或NO3-,所以电解质是NaNO3或Na2SO4或HNO3或H2SO4,
故答案为:NaNO3或Na2SO4或HNO3或H2SO4;
(2)当阴极析出金属,则金属离子为Cu2+或Ag+,阳极放出O2时,阴离子为SO42-或NO3-;所以电解质是CuSO4或AgNO3或Cu(NO3)2,
故答案为:CuSO4或AgNO3或Cu(NO3)2;
(3)当阴极放出H2,则阴极为H+放电溶液中的阳离子为Na+或H+,阳极放出Cl2阴离子为Cl-放电,所以电解质为NaCl或HCl,
故答案为:NaCl或HCl;
(4)电解过程中电解质和水都减少时,如阳极生成氧气,则阴极析出金属,应为CuSO4或AgNO3或Cu(NO3)2,如阴极析出氢气,则阳极应生成氯气,可为NaCl,
故答案为:CuSO4、AgNO3、Cu(NO3)2、NaCl.
(1)当阴极放出H2,阳极放出O2时,则溶液中的电解质不放电,溶液中阳离子为H+或Na+,阴离子为OH-或SO42-或NO3-,所以电解质是NaNO3或Na2SO4或HNO3或H2SO4,
故答案为:NaNO3或Na2SO4或HNO3或H2SO4;
(2)当阴极析出金属,则金属离子为Cu2+或Ag+,阳极放出O2时,阴离子为SO42-或NO3-;所以电解质是CuSO4或AgNO3或Cu(NO3)2,
故答案为:CuSO4或AgNO3或Cu(NO3)2;
(3)当阴极放出H2,则阴极为H+放电溶液中的阳离子为Na+或H+,阳极放出Cl2阴离子为Cl-放电,所以电解质为NaCl或HCl,
故答案为:NaCl或HCl;
(4)电解过程中电解质和水都减少时,如阳极生成氧气,则阴极析出金属,应为CuSO4或AgNO3或Cu(NO3)2,如阴极析出氢气,则阳极应生成氯气,可为NaCl,
故答案为:CuSO4、AgNO3、Cu(NO3)2、NaCl.
点评:本题考查电解原理,明确离子的放电顺序是解答本题的关键,注意电极材料与发生的电极反应即可解答,题目难度不大.

练习册系列答案
相关题目
锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水.当生成1mol硝酸锌时,参加反应硝酸的物质的量为( )
| A、2mol |
| B、3 mol |
| C、2.25mol |
| D、2.5mol |
 已知A、B、C、D、E五种物质中均为含有A元素,它们之间有如图所示转化关系,若A为气态非金属单质,按下列要求写出化学方程式
已知A、B、C、D、E五种物质中均为含有A元素,它们之间有如图所示转化关系,若A为气态非金属单质,按下列要求写出化学方程式 铁及铁化合物在生产、生活中有着重要的用途.
铁及铁化合物在生产、生活中有着重要的用途.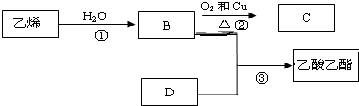 已知各物质能发生以下转化,根据框图回答:
已知各物质能发生以下转化,根据框图回答: