题目内容
8.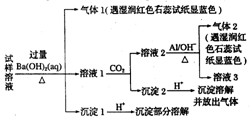 最近一段时间,武邑中学雾霾严重,影响了同学们的生活和健康.雾霾中可能含有如下离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-.高三1490班某同学收集了操场的雾霾,经必要的预处理后得试样溶液,设计并完成了如下实验,根据实验操作与现象,该同学得出的结论不正确的是( )【已知:3NO3-+8Al+5OH-+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$3NH3↑+8AlO2-】
最近一段时间,武邑中学雾霾严重,影响了同学们的生活和健康.雾霾中可能含有如下离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-.高三1490班某同学收集了操场的雾霾,经必要的预处理后得试样溶液,设计并完成了如下实验,根据实验操作与现象,该同学得出的结论不正确的是( )【已知:3NO3-+8Al+5OH-+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$3NH3↑+8AlO2-】| A. | 试样中一定存在的阴离子是SO42-和NO3- | |
| B. | 试样中一定不含Al3+ | |
| C. | 该雾霾中可能存在NaNO3、NH4Cl和MgSO4 | |
| D. | 试样中可能存在Na+、Cl- |
分析 试样溶液中加入过量Ba(OH)2并加热,生成的气体1,该气体1可能是NH3,则试样中含有NH4+;向滤液中通入CO2,得到溶液2、沉淀2,溶液2中加入Al,NO3-+A1+OH-+H2O→NH3↑+[Al(OH)4]-,生成气体2,该气体是NH3,根据已知条件知,溶液2中含有NO3-,根据元素守恒知,原溶液中含有NO3-;滤液1中通入CO2,得到沉淀2,向沉淀2中加入酸,沉淀溶解并放出气体,说明沉淀2是碳酸钡等难溶性碳酸盐;沉淀1加入酸后,沉淀部分溶解,硫酸钡不溶于酸,说明原来溶液中含有SO42-,能和过量Ba(OH)2反应生成能溶于酸的沉淀,根据提供的离子可知该沉淀为Mg(OH)2,所以溶液中含有Mg2+,以此解答该题.
解答 解:A.由分析可知溶液中含有NH4+、Mg2+、SO42-和NO3-,故A正确;
B.该实验不能确定是否含有铝离子,故B错误;
C.根据以上分析可知溶液中含有NH4+、Mg2+、SO42-和NO3-,则该雾C中可能存在NaNO3、NH4Cl和MgSO4,故C正确;
D.根据实验无法确定是否含有Na+、Cl-,所以溶液中可能含有Na+、Cl-,故D正确.
故选B.
点评 本题考查了常见离子的性质及检验方法,为高频考点,侧重考查学生的分析能力和实验能力的考查,题目难度中等,明确物质的性质及特殊反应现象是解本题关键,根据物质的溶解性、物质的性质及题给信息来分析解答.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
18.下列分散系最不稳定的是( )
| A. | 向NaOH溶液中通入CO2得到的无色溶液 | |
| B. | 向碘的水溶液中滴加四氯化碳充分振荡后,静置后的下层液体 | |
| C. | 向沸水中滴入饱和的FeCl3溶液得到的红褐色液体 | |
| D. | 向稀硫酸中加入BaCl2溶液得到的分散系 |
19.下列离子方程式,书写正确的是( )
| A. | 用惰性电极电解熔融氯化钠:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 铁粉溶于稀硫酸:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 用 CuSO4溶液吸收 H2S:Cu2++H2S═CuS↓+2H+ | |
| D. | 向 NH4HSO4 溶液中滴加少量的 Ba(OH)2溶液:Ba2++2OH-+NH+H2O+H++SO2-═BaSO4↓+NH3•H2O |
16.下列离子方程式正确的是( )
| A. | 用 KIO3氧化酸性溶液中的 KI:5I-+IO3-+3H2O═3I26OH- | |
| B. | 向(NH4)2Fe(SO4)2稀溶液中加一定量NaOH 溶液:NH++2Fe2++5OH-═NH3•H2O+2Fe(OH)2↓ | |
| C. | 向氯化铝溶液中滴入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 将少量SO2通入NaClO溶液:SO2+H2O+2ClO-═SO32-+2HClO |
3.下列叙述不正确的是( )
| A. | 在镀件上电镀铜时,可用金属铜作阳极 | |
| B. | 镀层破损后,白铁(镀锌)比马口铁(镀锡)更易被腐蚀 | |
| C. | 工业上电解饱和食盐水制烧碱,NaOH在阴极产生 | |
| D. | 钢铁在发生析氢腐蚀和吸氧腐蚀时,完全相同的反应是负极反应 |
17.下列说法正确的是( )
| A. | 浓度均为0.2mol•L-1的 Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)] | |
| B. | 浓度相等的a、NH4HSO4溶液、b、NH4HCO3溶液、c、NH4Cl溶液中的c(NH4+):a>b>c | |
| C. | NaHSO3溶液显酸性,c(Na+)>c(HSO3- )>c(H+)>c(OH-)>c(SO32-) | |
| D. | pH=3.6 的0.lmol/LHX 与0.lmol/LNaX 的混合溶液中,2c(H+)-2c(OH-)=c(X-)-c(HX) |
 ;
;