题目内容
12.已知:C(s)+O2(g)=CO2(g)△H1CO2(g)+C(s)=2CO(g)△H2
2CO(g)+O2(g)=2CO2(g)△H3
4Fe(s)+3O3(g)=2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是( )
| A. | △H1>0,△H3<0 | B. | △H1>△H2 | C. | △H1=△H2+△H3 | D. | △H3=△H4+△H5 |
分析 A.放热反应焓变值都小于0;
B.放热反应焓变值小于0,吸热反应焓变值大于0;
C.根据盖斯定律利用加合法进行分析;
D.根据盖斯定律利用加合法进行分析.
解答 解:A.C(s)+O2(g)=CO2(g)和2CO(g)+O2(g)=2CO2(g)都是放热反应,因此△H1<0,△H3<0,故A错误;
B.C(s)+O2(g)=CO2(g)为放热反应,所以△H1<0,CO2(g)+C(s)=2CO(g)为吸热反应,所以△H2>0,则,△H1<△H2,故B错误;
C.已知:①C(s)+O2(g)═CO2(g)△H1②CO2(g)+C(s)═2CO(g)△H2③2CO(g)+O2(g)═2CO2(g)△H3,由盖斯定律可知①=②+③,因此△H1=△H2+△H3,故C正确;
D.已知③2CO(g)+O2(g)═2CO2(g)△H3④4Fe(s)+3O2(g)═2Fe2O3(s)△H4⑤3CO(g)+Fe2O3(s)═3CO2(g)+2Fe(s)△H5,由盖斯定律可知③=$\frac{2}{3}$×($\frac{1}{2}$④+⑤),因此△H3=$\frac{1}{3}$△H4+$\frac{2}{3}$△H5,故D错误;
故选:C.
点评 本题考查了常见的吸热反应和放热反应类型、盖斯定律的计算,题目难度中等,熟悉常见的吸热反应和放热反应类型、根据盖斯定律利用加合法进行有关计算的步骤是解题的关键,注意比较反应热大小应带符号.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
2.下列说法不正确的是(NA为阿伏加德罗常数)( )
| A. | 46 g N2O4和NO2的混合物含原子总个数为3 NA | |
| B. | 钠在空气中燃烧可生成多种氧化物,则23g钠充分燃烧时转移电子数为1NA | |
| C. | 1 L 0.1 mol/L的KHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| D. | 60 g Si02中含Si-O键的个数为4 NA |
 材料的不断发展可以促进社会的进步.
材料的不断发展可以促进社会的进步. ,聚乙烯塑料属于热塑性(填“热固性”或“热塑性”)塑料.
,聚乙烯塑料属于热塑性(填“热固性”或“热塑性”)塑料. 4-甲基-3-乙基-2-己烯
4-甲基-3-乙基-2-己烯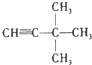 3,3-二甲基-1-丁炔.
3,3-二甲基-1-丁炔.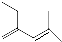 C8H14.
C8H14. .
.


 .
. ,现有苯的同系物,其蒸气密度为H2的60倍,该烃经氧化后,其产物1mol可中和3molNaOH,则该烃的结构可能有( )
,现有苯的同系物,其蒸气密度为H2的60倍,该烃经氧化后,其产物1mol可中和3molNaOH,则该烃的结构可能有( )