题目内容
13.工业上以铜屑、浓硝酸、水为主要原料生产硝酸铜,试运用所学的化学知识,设计出三种不同的制取硝酸铜的生产路线.(1)第一种方案是铜与氧气反应制得氧化铜,氧化铜与浓硝酸反应制得硝酸铜化学方程式是2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+2HNO3=Cu(NO3)2+H2O
(2)第二种方案是铜与浓硝酸制取硝酸铜化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(3)第三种方案是铜与稀硝酸制取硝酸铜化学方程式是3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(4)从资源的有效利用和环境保护两个方面对上述三种生产路线进行简要评析方案一不会产生有毒气体,环保且没有多消耗原料,第二方案有二氧化氮产生且原料消耗多,第三种方案有一氧化氮污染空气同时消耗的硝酸也比方案一多,所以方案一的方法最为合理
(5)为制得纯净硝酸铜、要除去铁、钴、镍等杂质,实际操作是:
①在制得的硝酸铜溶液里加入氧化铜,调节溶液pH为4后通入过热水蒸气,使Fe(OH)2沉淀析出并过滤除去
②将所得溶液蒸发并析出Cu(NO3)2.6H2O晶体,简析其化学原理,丙写出相关的化学方程式.
分析 工业上以铜屑、浓硫酸、水为主要原料生产硝酸铜,可以用铜与浓硝酸反应,也要以用铜在空气中加热氧化得氧化铜再与硝酸反应得硝酸铜,或者将浓硝酸稀释成稀硝酸,用铜与稀硝酸反应制取硝酸铜,一氧化氮和二氧化氮对环境污染,在制得的硝酸铜溶液里含有硝酸,加入氧化铜,氧化铜与酸反应,调节溶液pH为4后通入过热水蒸气,铁离子水角,使Fe(OH)3沉淀析出并过滤除去,将所得溶液蒸发浓缩、蒸发结晶,析出Cu(NO3)2.6H2O晶体,据此答题.
解答 解:工业上以铜屑、浓硫酸、水为主要原料生产硝酸铜,可以用铜与浓硝酸反应,也要以用铜在空气中加热氧化得氧化铜再与硝酸反应得硝酸铜,或者将浓硝酸稀释成稀硝酸,用铜与稀硝酸反应制取硝酸铜,一氧化氮和二氧化氮对环境污染,在制得的硝酸铜溶液里含有硝酸,加入氧化铜,氧化铜与酸反应,调节溶液pH为4后通入过热水蒸气,铁离子水角,使Fe(OH)3沉淀析出并过滤除去,将所得溶液蒸发浓缩、蒸发结晶,析出Cu(NO3)2.6H2O晶体,
(1)第一种方案是将铜与氧气反应制得氧化铜,氧化铜与浓硝酸反应制得硝酸铜,化学方程式是2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+2HNO3=Cu(NO3)2+H2O,
故答案为:铜与氧气反应制得氧化铜,氧化铜与浓硝酸反应制得硝酸铜;2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+2HNO3=Cu(NO3)2+H2O;
(2)第二种方案是 铜与浓硝酸制取硝酸铜,化学方程式是 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
故答案为:铜与浓硝酸制取硝酸铜;Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(3)第三种方案是 铜与稀硝酸制取硝酸铜,化学方程式是 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
故答案为:铜与稀硝酸制取硝酸铜;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(4)从上述三种方案的过程可以看出,方案一不会产生有毒气体,环保且没有多消耗原料,第二方案有二氧化氮产生且原料消耗多,第三种方案有一氧化氮污染空气同时消耗的硝酸也比方案一多,所以方案一的方法最为合理,
故答案为:方案一不会产生有毒气体,环保且没有多消耗原料,第二方案有二氧化氮产生且原料消耗多,第三种方案有一氧化氮污染空气同时消耗的硝酸也比方案一多,所以方案一的方法最为合理;
(5)为制得纯净硝酸铜、要除去铁、钴、镍等杂质,在制得的硝酸铜溶液里含有硝酸,加入氧化铜,氧化铜与酸反应,调节溶液pH为4,反应方程式为CuO+2HNO3=Cu(NO3)2+H2O,后通入过热水蒸气,铁离子水解,使Fe(OH)3沉淀析出并过滤除去,反应方程式为Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+,将所得溶液蒸发浓缩、蒸发结晶,析出Cu(NO3)2.6H2O晶体,
答:在制得的硝酸铜溶液里含有硝酸,加入氧化铜,氧化铜与酸反应,调节溶液pH为4,反应方程式为CuO+2HNO3=Cu(NO3)2+H2O,后通入过热水蒸气,铁离子水解,使Fe(OH)3沉淀析出并过滤除去,反应方程式为Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+,将所得溶液蒸发浓缩、蒸发结晶,析出Cu(NO3)2.6H2O晶体.
点评 本题以硝酸铜的制备为命题的出发点,将改进优化的过程设计成一个探究性的试题,旨在考查学生的基础知识、分析问题解决问题的能力、实验操作与实验方案的评价能力、绿色化学的观点等.

| A. | 将纳米碳(粒子直径为1~100nm的材料)均匀地分散到蒸馏水中,所形成的体系是胶体 | |
| B. | 氢氧化铁胶体带正电,所以进行电泳实验时,阴极区域颜色加深 | |
| C. | 可以用丁达尔效应区分氢氧化铁胶体和碘水 | |
| D. | 明矾和硫酸铁的净水原理相同 |
| A. | 三聚氰胺的摩尔质量为126g/mol | |
| B. | 三聚氰胺分子中各元素原子的物质的量之比为n(C):n(H):n(N)=1:2:2 | |
| C. | 三聚氰胺分子中各元素的质量比为m(C):m(H):m(N)=6:1:14 | |
| D. | 标准状况下,1mol三聚氰胺所占的体积约为22.4 L |
| A. | 含有NA个二氧化碳分子 | B. | 含有1molO2 | ||
| C. | 质量为44 g•mol-1 | D. | 所占的体积为22.4L |
| 乙醇 | 溴乙烷 | 1-丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(2)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在下层(填“上层”、“下层”或“不分层”).
(3)制备操作中,加入的浓硫酸必需进行稀释,目的是abc.(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是c.(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于平衡向生成溴乙烷的方向移动;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷和正丁醇的沸点相差不大.
| A. | HCl、NaOH、Ba(OH)2 | B. | HCl、KOH、NaCl | C. | H2SO4、HCl、NaCl | D. | H2SO4、NaOH、KOH |
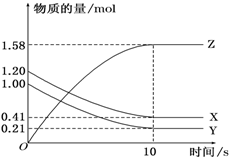 一定温度下,某1L体积固定的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题:
一定温度下,某1L体积固定的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题: