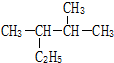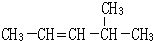题目内容
下列各组反应中,硝酸既表现了氧化性,又表现了酸性的是( )
| A、C+HNO3 |
| B、SO2+HNO3 |
| C、Fe(OH)3+HNO3 |
| D、FeO+HNO3 |
考点:硝酸的化学性质
专题:氮族元素
分析:硝酸既表现酸性,又表现氧化性,说明反应过程中部分硝酸中元素化合价不变,部分硝酸中得电子化合价降低,根据元素化合价来分析解答.
解答:
解:A.C+4HNO3=4NO2↑+CO2↑+2H2O,该反应中硝酸得电子化合价降低,只表现氧化性,故A错误;
B.SO2+2HNO3=2NO2↑+H2SO4,该反应中硝酸得电子化合价降低,只表现氧化性,故B错误;
C.Fe(OH)3+3HNO3=Fe(NO3)3+3H2O,该反应中没有元素化合价变化,为非氧化还原反应,所以硝酸只表现酸性,故C错误;
D.FeO+4HNO3=Fe(NO3)3+2H2O+NO2↑,该反应中部分硝酸得电子化合价降低,部分硝酸化合价不变,所以硝酸既表现酸性,又表现氧化性,故D正确,
故选D.
B.SO2+2HNO3=2NO2↑+H2SO4,该反应中硝酸得电子化合价降低,只表现氧化性,故B错误;
C.Fe(OH)3+3HNO3=Fe(NO3)3+3H2O,该反应中没有元素化合价变化,为非氧化还原反应,所以硝酸只表现酸性,故C错误;
D.FeO+4HNO3=Fe(NO3)3+2H2O+NO2↑,该反应中部分硝酸得电子化合价降低,部分硝酸化合价不变,所以硝酸既表现酸性,又表现氧化性,故D正确,
故选D.
点评:本题考查硝酸的性质,根据元素化合价来分析解答即可,明确元素化合价是解本题关键,题目难度不大.

练习册系列答案
相关题目
在一定温度下,容器内某一反应中M、N的物质的量n随反应时间t变化的曲线如图所示,下列表述中正确的是( )


| A、反应的化学方程式为2M?N |
| B、t2时V正=V逆,达到平衡 |
| C、t3时V正>V逆 |
| D、t1时浓度C(N)=2C(M) |
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属元素;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9.单质Y和W都可与浓的NaOH溶液反应.下列说法不正确的是( )
| A、原子半径:Y>Z>W |
| B、非金属性最强的元素为W |
| C、Y的最高价氧化物对应的水化物为强碱 |
| D、XW2分子中各原子最外层电子未达到8电子结构 |
对于固定体积的密闭容器中进行的气体反应A(g)+B(g)?C(g)+D(g),可以说明在恒温下该反应已达到平衡的是( )
| A、反应容器的压强不随时间而变化 |
| B、A气体和B气体的生成速率相等 |
| C、A气体和C气体的生成速率相等 |
| D、反应混合气体的密度不随时间而变化 |
在Cu与稀HNO3的反应中,若有1mol HNO3被还原,则被氧化的Cu的物质的量为( )
A、
| ||
B、
| ||
| C、3mol | ||
D、
|
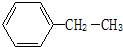
主链含有4个碳原子,且含有4个甲基的烷烃有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
下列数值表示有关元素的原子序数,各组数字中表示的元素的原子之间能形成离子键的是( )
| A、10 与 19 |
| B、6 与 16 |
| C、11 与 17 |
| D、14 与 8 |