题目内容
11.将m g的镁、铜合金加到一定量的稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO).向反应后溶液中加入5mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金质量增加10.2g,则下列叙述正确的是( )| A. | 当金属全部溶解时,无法计算出参与反应的硝酸的物质的量 | |
| B. | 7.2<m<19.2 | |
| C. | 当金属全部溶解时,收集到NO气体的体积一定为4.48L | |
| D. | 当生成沉淀的量达到最大值时,消耗NaOH溶液的体积为120mL |
分析 将一定量的镁和铜合金加入到稀HNO3中,二者恰好反应,金属、硝酸都没有剩余,反应中还原产物只有NO,发生反应:3Mg+8HNO3(稀)═3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;
向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH═Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH═Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加10.2g,则氢氧化镁和氢氧化铜含有氢氧根的质量为10.2g,氢氧根的物质的量为$\frac{10.2g}{17g/mol}$=0.6mol,根据电子转移守恒,则镁和铜的总的物质的量为0.3mol,生成NO为0.2mol,
A.根据方程式可知参加反应的n反应(HNO3)=$\frac{8}{3}$n(金属);
B.金属的总质量与金属的含量有关,假定全为镁、全为铜计算确定金属的质量范围;
C.温度、压强未知,不能计算NO的体积;
D.可能剩余硝酸,无法计算加入的氢氧化钠溶液的体积.
解答 解:将一定量的镁和铜合金加入到稀HNO3中,二者恰好反应,金属、硝酸都没有剩余,反应中还原产物只有NO,发生反应:3Mg+8HNO3(稀)═3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;
向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH═Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH═Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加10.2g,则氢氧化镁和氢氧化铜含有氢氧根的质量为10.2g,氢氧根的物质的量为$\frac{10.2g}{17g/mol}$=0.6mol,根据电子转移守恒,则镁和铜的总的物质的量为$\frac{0.6mol}{2}$=0.3mol,生成NO为$\frac{0.6mol}{3}$=0.2mol,
A.根据方程式可知,参加反应的n反应(HNO3)=$\frac{8}{3}$n(金属)=$\frac{8}{3}$×0.3mol=1.8mol,故A错误;
B.镁和铜的总的物质的量为0.3mol,假定全为镁,质量为0.3mol×24g/mol=7.2g,若全为铜,质量为0.3mol×64g/mol=19.2g,所以参加反应的金属的总质量(m)为7.2g<m<19.2g,故B正确;
C.温度、压强未知,不能确定气体摩尔体积,不能计算NO的体积,故C错误;
D.与硝酸镁、硝酸铜反应消耗NaOH为0.6mol,该部分NaO溶液的体积为$\frac{0.6mol}{5mol/L}$=0.12L=120mL,而硝酸可能有剩余,无法计算加入的氢氧化钠溶液的体积,故D错误.
故选:B.
点评 本题主要考查混合物有关计算,综合考查学生的得失电子守恒、质量守恒等综合运用和解决复杂问题的能力,是一道考查能力的好题,注意反应中硝酸可能有剩余.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 37g37Cl2中含有20 NA个质子 | B. | 18 g 2H216O中含有10 NA个电子 | ||
| C. | 26Mg2+中含有10 NA个电子 | D. | 1mol18O中含有10 NA个中子 |
| A. | 氟化铵的电子式: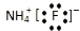 | |
| B. | 原子最外层只有1个电子的元素一定是金属元素 | |
| C. | 离子结构示意图: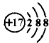 ,可以表示35Cl-,也可以表示37Cl- ,可以表示35Cl-,也可以表示37Cl- | |
| D. | 1mol CH4与1mol NH4+所含质子数相等 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | ||||||
| 三 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 四 | ② | ④ | ⑨ |
(2)②和⑧形成的化合物灼烧时焰色为紫色;
(3)元素⑦的氢化物常温下和元素②的单质反应的离子方程式是2K+2H2O═2K++2OH-+H2↑,用元素⑧的单质制备漂白液的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O;
(4)②③④中形成的简单离子半径由大到小的顺序是K+>Ca2+>Mg2+;
(5)写出①和⑦形成的稳定化合物的电子式
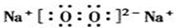 ;
;(6)用电子式表示⑥和⑦形成化合物的形成过程
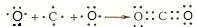 .
. | A. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| B. | 检验某卤代烃中是否含溴:加入NaOH溶液,加热,冷却,再加入硝酸银溶液 | |
| C. | 苯不能与溴水发生取代反应,用苯能萃取溴的四氯化碳溶液中的溴 | |
| D. | 利用核磁共振氢谱,可以鉴别CH3OCH3和CH3CH2OH |
| A. | 透明的溶液中:Al3+、Cu2+、SO42-、NO3- | |
| B. | 通入SO2的溶液中:Fe3+、Ba2+、Cl-、NO3- | |
| C. | 加入铝粉产生H2的溶液中:NH4+、Fe3+、SO42-、NO3- | |
| D. | 常温下,由水电离出的c(H+)=1×10-12mol/L:K+、Ba2+、Cl-、NO3- |
| A. | 质子数为8、中子数为10的氧原子:${\;}_{16}^{8}$O | |
| B. | 过氧化氢的电子式: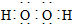 | |
| C. | 氧原子的价电子排布图: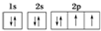 | |
| D. | 次氯酸的结构式:H-Cl-O |

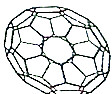 目前,化学家们已经找到十余种富勒烯家族的Cn,它们分子结构中都由正五边形和正六边形构成的封闭的凸多面体,C60就是其中的一种富勒烯,其结构如图所示,下列物质不属于富勒烯家族的是( )
目前,化学家们已经找到十余种富勒烯家族的Cn,它们分子结构中都由正五边形和正六边形构成的封闭的凸多面体,C60就是其中的一种富勒烯,其结构如图所示,下列物质不属于富勒烯家族的是( )