题目内容
11.下列离子方程式中,属于水解反应的是( )| A. | HS-+H2O?H3O++S2- | B. | CO2+2 H2O?HCO3-+H3O+ | ||
| C. | NH4++2H2O?NH3•H2O+H3O+ | D. | HCO3-+OH-?CO32-+H2O |
分析 水解反应中有水参加反应,为弱酸离子或弱碱离子与水电离的氢离子或氢氧根离子结合生成弱电解质的反应,以此来解答.
解答 解:A.HS-+H2O?H3O++S2-为HS-的电离方程式,故A不选;
B.CO2+2 H2O?HCO3-+H3O+为碳酸的第一步电离方程式,故B不选;
C.NH4++2H2O?NH3•H2O+H3O+为铵根离子的水解方程式,故C选;
D.碳酸氢根离子和氢氧根离子之间反应生成碳酸根离子和水,不属于水解反应,是发生了化学反应,故D不选;
故选C.
点评 本题考查离子反应,侧重水解的离子反应的考查,明确水解的离子反应、电离的离子反应、化学反应中的离子反应即可解答,注重反应类型的分析,题目难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
6.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
| A. | Fe$→_{高温}^{Al_{2}O_{3}}$Al$\stackrel{NaOH(aq)}{→}$H2 | |
| B. | MgCl2•6H2O$→_{△}^{HCl}$MgCl2$\stackrel{熔融电解}{→}$Mg | |
| C. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{NaOH(aq)}{→}$NaNO2 | |
| D. | SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO3(s)$\stackrel{O_{2}}{→}$BaSO4(s) |
16.某温度下,在一恒容密闭容器中进行可逆反应:X(g)+Y(g)?Z(g)+W(s)△H>0,下列叙述正确的是( )
| A. | 当容器中混合气体的压强不再变化时,反应达到平衡 | |
| B. | 平衡后加入少量W,逆反应速率增大 | |
| C. | 平衡后升高温度,平衡逆向移动 | |
| D. | 平衡后加入X,△H增大 |
3.下列叙述正确的是( )
| A. | 稀硝酸是弱酸,浓硝酸是强酸 | |
| B. | 稀硝酸与活泼金属反应主要放出氢气,而浓硝酸则通常使金属钝化 | |
| C. | 浓硝酸、稀硝酸和浓硫酸都是强氧化剂 | |
| D. | 室温下,铜既可与浓硝酸反应,又可与稀硫酸反应 |
20.某原电池结构如图所示,下列有关该原电池的说法错误的是( )
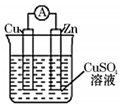

| A. | 锌棒为负极 | B. | 锌棒发生氧化反应 | ||
| C. | 反应后铜棒质量增重 | D. | 电子从铜棒经外电路流向锌棒 |
20.下列有关金属腐蚀与防护的说法不正确的是( )
| A. | 纯银器的表面在空气中因化学腐蚀渐渐变暗 | |
| B. | 当镀锡铁制品的镀层破损时,镀层不能对铁制品起保护作用 | |
| C. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
 .
.