题目内容
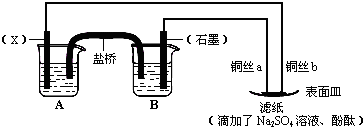
依据氧化还原反应:2Fe3+(aq)+Fe(s)═3Fe2+(aq),设计原电池并完成如图所示实验.
请回答下列问题:
(1)电极X的材料是 ;石墨电极为电池的 极.
(2)B装置中发生的电极反应方程式为 ;表面皿中溶质Na2SO4的作用是 .
(3)铜丝b与滤纸接触处的现象为 ;此处电极反应方程式为: .

请回答下列问题:
(1)电极X的材料是
(2)B装置中发生的电极反应方程式为
(3)铜丝b与滤纸接触处的现象为
考点:设计原电池
专题:
分析:由图可知,X为Fe,作负极,电极反应为Fe-2e-═Fe2+;石墨为正极,电极反应为2Fe3++2e-═2Fe2+;则a为阳极,b为阴极,电解硫酸钠溶液,实质为电解水,以此来解答.
解答:
解:(1)由电池反应2Fe3+(aq)+Fe(s)═3Fe2+(aq)可知,Fe失去电子,则电极材料X为铁,石墨电极为正极,故答案为:Fe;正;
(2)B装置中发生的电极反应方程式为Fe3++e-═Fe2+,表面皿中溶质Na2SO4的作用是增强溶液的导电性,故答案为:Fe3++e-═Fe2+;增强溶液的导电性;
(3)铜丝b与电源负极相连,为阴极,发生电极反应为2H2O+2e-═H2↑+2OH-,则滤纸接触处有碱和酚酞,可观察到的现象为滤纸变为红色,
故答案为:滤纸变为红色;2H2O+2e-═H2↑+2OH-.
(2)B装置中发生的电极反应方程式为Fe3++e-═Fe2+,表面皿中溶质Na2SO4的作用是增强溶液的导电性,故答案为:Fe3++e-═Fe2+;增强溶液的导电性;
(3)铜丝b与电源负极相连,为阴极,发生电极反应为2H2O+2e-═H2↑+2OH-,则滤纸接触处有碱和酚酞,可观察到的现象为滤纸变为红色,
故答案为:滤纸变为红色;2H2O+2e-═H2↑+2OH-.
点评:本题考查原电池的设计及应用,为高频考点,把握原电池、电解的工作原理为解答的关键,侧重分析与应用能力的考查,注意电极反应的书写,题目难度不大.

练习册系列答案
相关题目
往盛氯水的试管里滴入少量紫色石蕊试液,观察到的现象是( )
| A、紫色石蕊试液显蓝色 |
| B、紫色石蕊试液显红色 |
| C、紫色石蕊试液的颜色消失 |
| D、紫色石蕊试液先显红色,后红色消失 |
(NH4)2PtCl6 晶体受热分解生成氮气、氯化氢、氯化铵和金属铂.在此分解反应中,氧化产物与还原产物的物质的量之比是( )
| A、1:3 | B、1:2 |
| C、3:2 | D、2:3 |
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质下列说法正确的是( )
| A、糖类、油脂、蛋白质都能发生水解反应,其中油脂在碱性条件下的水解称为皂化反应 |
| B、淀粉和纤维素互为同分异构体,都能水解为还原性的糖 |
| C、糖类、油脂、蛋白质都是高分子化合物 |
| D、植物油能使溴的四氯化碳溶液褪色 |
如图所示铜锌电池,下列叙述错误的是( )
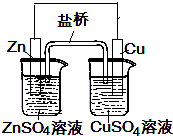

| A、锌是负极,发生氧化反应 |
| B、铜是正极,发生还原反应 |
| C、电流是从Zn流出经导线流入铜电极 |
| D、锌电极质量减少,铜电极质量增加 |
波尔多液农药不能用铁制容器盛放,是因为铁能与农药中的硫酸铜反应.在该反应中铁( )
| A、是催化剂 | B、得到电子 |
| C、是还原剂 | D、发生了还原反应 |
图(1)废电池需要集中处理,主要原因是电池中含有的( )元素掺入生活垃圾中进行填埋时,会通过渗液污染水体和土壤.
| A、Al | B、Ag | C、Hg | D、Na |
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有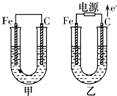 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题: