题目内容
7.在一定条件下,将H2与CO2分别按n(H2):n(CO2)=1.5、2投入某恒压密闭容器中,发生反应:6H2+2CO2?C2H5OH+3H2O,测得不同温度时CO2的平衡转化率,呈如下两条曲线:
下列说法不正确的是( )
| A. | 达平衡时,6v(H2)正=2 v(CO2)逆 | B. | 正反应的反应热:△H<0 | ||
| C. | 平衡常数:Kb<Kc | D. | 曲线I的投料:n(H2):n(CO2)=2 |
分析 A.根据达平衡时,v正=v逆判断;
B.由图可知,随温度升高CO2的平衡转化率减小,说明升高温度平衡逆向移动,则正反应为放热反应;
C.随温度升高CO2的平衡转化率减小,说明升高温度平衡逆向移动,平衡常数减小;
D.根据氢碳比即n(H2):n(CO2)越大,则二氧化碳的转化率越大判断.
解答 解:A.达平衡时,v正=v逆,所以2v(H2)正=6 v(CO2)逆,故A错误;
B.由图可知,随温度升高CO2的平衡转化率减小,说明升高温度平衡逆向移动,升高温度平衡向吸热反应越大,则正反应为放热反应,故△H<0,故B正确;
C.随温度升高CO2的平衡转化率减小,说明升高温度平衡逆向移动,平衡常数减小,又b点温度高于c,所以Kb<Kc,故C正确;
D.氢碳比即n(H2):n(CO2)越大,则二氧化碳的转化率越大,故曲线I的投料:n(H2):n(CO2)=2,故D正确,
故选:A.
点评 本题考查化学平衡计算与影响因素、平衡常数、化学平衡图象等,侧重考查对图象的分析获取信息能力,难度中等.

练习册系列答案
相关题目
3.下列有关分枝酸的叙述中,正确的是( )
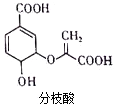

| A. | 分子中含有2种官能团 | |
| B. | 一定条件下,能与乙醇或乙酸发生相同类型的反应 | |
| C. | 1mol分枝酸最多可与3molNaOH发生反应 | |
| D. | 可运用同一原理分别使溴的四氯化碳溶液与酸性高锰酸钾溶液褪色 |
4.若在加入铝粉能产生氢气的无色溶液中,分别加入下列各组离子,可能共存的是( )
| A. | NH4+、NO3-、Al3+、Cl- | B. | Na+、AlO2-、K+、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | AlO2-、K+、NO3-、OH- |
15.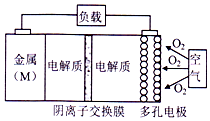 电池的“理论比能量”指单位质量的电极材料理论上能释放的最大电能.“金属(M)〜空气电池”(如下图)具有原料易得、能量密度高等优点.该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH) n.下列说法不正确的是( )
电池的“理论比能量”指单位质量的电极材料理论上能释放的最大电能.“金属(M)〜空气电池”(如下图)具有原料易得、能量密度高等优点.该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH) n.下列说法不正确的是( )
 电池的“理论比能量”指单位质量的电极材料理论上能释放的最大电能.“金属(M)〜空气电池”(如下图)具有原料易得、能量密度高等优点.该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH) n.下列说法不正确的是( )
电池的“理论比能量”指单位质量的电极材料理论上能释放的最大电能.“金属(M)〜空气电池”(如下图)具有原料易得、能量密度高等优点.该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH) n.下列说法不正确的是( )| A. | “金属(M)〜空气电池”放电过程的正极反应式:O2+2H2O+4e-=4M(OH)n | |
| B. | 比较Mg、Al、Zn三种“金属-空气电池”,“Al-空气电池”的理论比能量最高 | |
| C. | 电解质溶液中的阴离子从负极区移向正极区 | |
| D. | 在“M-空气电池”中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 |
12.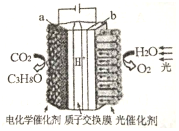 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O 和CO2转化为O2 和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O 和CO2转化为O2 和燃料(C3H8O).下列说法正确的是( )
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O 和CO2转化为O2 和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O 和CO2转化为O2 和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从b 极区向a 极区迁移 | |
| C. | 每生成1 mol O2,外电路有2 mol 电子转移 | |
| D. | a 电极的反应为:3CO2+18H+-18e--=C3H8O+5H2 O |
19.化学与生产、生活密切相关,下列说法不正确的是( )
| A. | 铝及其合金广泛应用,是因为铝的性质稳定,不易被腐蚀 | |
| B. | 用乙烯作为水果的催熟剂,以使生水果尽快成熟 | |
| C. | 工业上燃烧煤时,加入少量石灰石是为了减少SO2的排放 | |
| D. | 误食重金属盐引起人体中毒,可喝牛奶或豆浆解毒 |
16.合成药物异搏定路线中某一步骤如图:
 +
+ $\stackrel{HaH,DMF}{→}$
$\stackrel{HaH,DMF}{→}$ ,下列说法不正确的是( )
,下列说法不正确的是( )
 +
+ $\stackrel{HaH,DMF}{→}$
$\stackrel{HaH,DMF}{→}$ ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 物质X中所有碳原子可能共平面 | |
| B. | 可用FeCl3溶液鉴别Z中是否含有X | |
| C. | 等物质的量的X、Z分别与H2加成,最多消耗H2的物质的量之比为3:5 | |
| D. | 等物质的量的Y、Z分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为1:1 |
17.除去下列物质中混有的少量杂质(括号内为杂质),所用试剂正确的是( )
| A | Cl2(HCl) | NaOH溶液 |
| B | Fe2O3(Al2O3) | NaOH溶液 |
| C | Na2CO3溶液(NaCl) | AgNO3溶液 |
| D | Na2SO4溶液(Na2CO3) | 稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
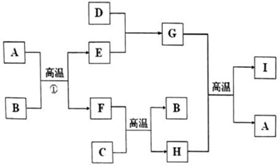 有关物质的转化关系如图所示(部分物质与条件己略去).A是最常见的无色液体,B、C是常见的金属单质,D、E是气体单质,且D在空气中的含量最多,F 是一种具有磁性的化合物,H是既能与强酸反应又能与强碱反应的氧化物:I具有耐高温、抗冲击、导热性好的优良性质,广泛应用于电子工业、陶瓷工业中.
有关物质的转化关系如图所示(部分物质与条件己略去).A是最常见的无色液体,B、C是常见的金属单质,D、E是气体单质,且D在空气中的含量最多,F 是一种具有磁性的化合物,H是既能与强酸反应又能与强碱反应的氧化物:I具有耐高温、抗冲击、导热性好的优良性质,广泛应用于电子工业、陶瓷工业中. .
.