题目内容
氨在工农业生产中应用广泛.图1为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数.

(1)从表可以看出:a.在温度相同时,随着压强的增大,平衡混合物中氨的体积分数 (填“增大”、“减小”或“不变”),说明合成氨的正反应是一个气体分子数 (同上)的反应.b.在压强相同时,随着温度的升高,平衡混合物中氨的体积分数 (填“增大”、“减小”或“不变”),说明合成氨的正反应是 (填“吸热”或“放热”)反应.
(2)从图1可看出:300℃时,压强p1条件下,平衡混合物中氨的体积分数 (填“>”、“<”或“=”)压强p2条件下平衡混合物中氨的体积分数,由此可p1 p2(填“>”、“<”或“=”).
(3)该反应在300℃时的平衡常数K1 (填“>”、“<”或“=”)500℃时的平衡常数K2.
(4)表为氨的产量与温度、压强的关系,试画出在30MPa下,300℃和500℃下,氨的平衡百分含量x(NH3)-时间t曲线图2,并标明平衡时氨的百分含量.

| 压强(MPa) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 氨的平衡含量(%) | ||||||
| 温度(摄氏度) | ||||||
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.1 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
(2)从图1可看出:300℃时,压强p1条件下,平衡混合物中氨的体积分数
(3)该反应在300℃时的平衡常数K1
(4)表为氨的产量与温度、压强的关系,试画出在30MPa下,300℃和500℃下,氨的平衡百分含量x(NH3)-时间t曲线图2,并标明平衡时氨的百分含量.
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:(1)a看表的横行可知,在温度相同时,随着压强的增大,平衡混合物中氨的体积分数逐渐增大,压强增大平衡正向移动,说明正反应是一个分子数减小的反应,b看表格的纵行可知,在压强相同时,随着温度的升高,平衡混合物中氨的体积分数逐渐减小,平衡逆向移动,说明合成氨的反应是放热反应,据此答题;
(2)从图1可看出,300℃时,压强p1条件下,平衡混合物中氨的体积分数>压强p2条件下平衡混合物中氨的体积分数,而合氨的反应是体积减小的反应,所以可以看出P1>P2,据此答题;
(3)由于合成氨是放热反应,升高温度,平衡逆向移动,平衡常数减小,据此判断K1和K2的大小;
(4)出在30MPa下,300℃时反应速率小于500℃下,但由于该反应为放热反应,所以出在300℃时氨的平衡百分含量高于500℃时的,根据表可知,它们分别为71.0%和26.4%,据此画图.
(2)从图1可看出,300℃时,压强p1条件下,平衡混合物中氨的体积分数>压强p2条件下平衡混合物中氨的体积分数,而合氨的反应是体积减小的反应,所以可以看出P1>P2,据此答题;
(3)由于合成氨是放热反应,升高温度,平衡逆向移动,平衡常数减小,据此判断K1和K2的大小;
(4)出在30MPa下,300℃时反应速率小于500℃下,但由于该反应为放热反应,所以出在300℃时氨的平衡百分含量高于500℃时的,根据表可知,它们分别为71.0%和26.4%,据此画图.
解答:
解:(1)a看表的横行可知,在温度相同时,随着压强的增大,平衡混合物中氨的体积分数逐渐增大,压强增大平衡正向移动,说明正反应是一个分子数减小的反应,b看表格的纵行可知,在压强相同时,随着温度的升高,平衡混合物中氨的体积分数逐渐减小,平衡逆向移动,说明合成氨的反应是放热反应,
故答案为:增大;减小;减小;放热;
(2)从图1可看出,300℃时,压强p1条件下,平衡混合物中氨的体积分数>压强p2条件下平衡混合物中氨的体积分数,而合氨的反应是体积减小的反应,所以可以看出P1>P2,故答案为:>;>;
(3)由于合成氨是放热反应,升高温度,平衡逆向移动,平衡常数减小,据此判断K1>K2,故答案为:>;
(4)出在30MPa下,300℃时反应速率小于500℃下,但由于该反应为放热反应,所以出在300℃时氨的平衡百分含量高于500℃时的,根据表可知,它们分别为71.0%和26.4%,据此画出的图为: ,故答案为:
,故答案为: .
.
故答案为:增大;减小;减小;放热;
(2)从图1可看出,300℃时,压强p1条件下,平衡混合物中氨的体积分数>压强p2条件下平衡混合物中氨的体积分数,而合氨的反应是体积减小的反应,所以可以看出P1>P2,故答案为:>;>;
(3)由于合成氨是放热反应,升高温度,平衡逆向移动,平衡常数减小,据此判断K1>K2,故答案为:>;
(4)出在30MPa下,300℃时反应速率小于500℃下,但由于该反应为放热反应,所以出在300℃时氨的平衡百分含量高于500℃时的,根据表可知,它们分别为71.0%和26.4%,据此画出的图为:
 ,故答案为:
,故答案为: .
.
点评:本题主要考查了影响平衡移动的外界因素,难度不大,注重对基本原理的理解.

练习册系列答案
相关题目
下列叙述中正确的是( )
| A、一切四面体空间构型的分子内键角均为109°28′ |
| B、Cu(OH)2能溶于过量氨水形成络合物[Cu(NH3)4]2+,中心离子为Cu2+,配位体是NH3 |
| C、任何晶体,若含阳离子也一定含阴离子 |
| D、水分子稳定是因为水分子间存在氢键作用 |
从一杯蔗糖溶液的上部取一些溶液,测定它的密度为a g/cm3,再从下部取一些溶液,测定它的密度数值应为( )
| A、大于a | B、小于a |
| C、等于a | D、无法确定 |
下列图示与对应的叙述相符合的是( )
A、 N2(g)+3H2?2NH3(g)△H<0 |
B、 FeCl3+3KSCN?Fe(SCN)3+3KCl |
C、 向稀醋酸中加入醋酸钠溶液 |
D、 稀释苏打溶液 |
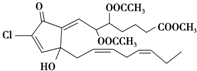 从一种珊瑚中分离出的活性含氯化合物punaglandin具有很强的抗癌活性,它的结构简式如图,有关该化合物的说法正确的是( )
从一种珊瑚中分离出的活性含氯化合物punaglandin具有很强的抗癌活性,它的结构简式如图,有关该化合物的说法正确的是( )| A、分子有3种含氧官能团 |
| B、分子中所有碳原子可以处于同一平面 |
| C、1mol该物质最多消耗4mol NaOH或3mol Br2 |
| D、该物质中只有一种官能团能使酸性高锰酸钾溶液褪色 |
