题目内容
按要求填空.
(1)写出下列物质的电子式:
NH3: H2O2:
MgO: CO2:
(2)选择适当的物质的序号填空.
①MgCl2 ②金刚石 ③NH4Cl ④C60 ⑤H2O ⑥Cl2 ⑦KNO3 ⑧SiO2
以上属于原子晶体的是: ,属于分子晶体的是 ;属于离子晶体的是: ;既有离子键又有共价键的是 .
(1)写出下列物质的电子式:
NH3:
MgO:
(2)选择适当的物质的序号填空.
①MgCl2 ②金刚石 ③NH4Cl ④C60 ⑤H2O ⑥Cl2 ⑦KNO3 ⑧SiO2
以上属于原子晶体的是:
考点:电子式,化学键,离子晶体,原子晶体,分子晶体
专题:化学键与晶体结构
分析:(1)氨气中3个氢原子分别与氮原子通过共用1对电子结合;
过氧化氢中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合.
氧化镁为离子晶体,由镁离子与氧离子通过离子键结合在一起;
二氧化碳中两个氧原子分别与碳原子通过共用两对电子结合;
(1)由阴阳离子构成的晶体属于离子晶体,由分子构成的晶体属于分子晶体,由原子构成的空间网状结构晶体属于原子晶体,根据晶体的构成微粒判断晶体类型;离子键是阴阳离子间的静电作用,共价键是原子间通过共用电子对形成的相互作用;
过氧化氢中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合.
氧化镁为离子晶体,由镁离子与氧离子通过离子键结合在一起;
二氧化碳中两个氧原子分别与碳原子通过共用两对电子结合;
(1)由阴阳离子构成的晶体属于离子晶体,由分子构成的晶体属于分子晶体,由原子构成的空间网状结构晶体属于原子晶体,根据晶体的构成微粒判断晶体类型;离子键是阴阳离子间的静电作用,共价键是原子间通过共用电子对形成的相互作用;
解答:
解:(1)氨气为共价化合物,氨气中存在3个氮氢键,氨气的电子式为: ;
;
过氧化氢为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ;
;
氧化镁是离子化合物,由镁离子与氧离子构成,氧化镁的电子式为 ;
;
二氧化碳为共价化合物,分子中存在两个碳氧双键,二氧化碳的电子式为: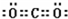
故答案为: ;
; ;
; ;
; ;
;
(2)①MgCl2晶体是由镁离子和氯离子构成的,为离子晶体;
②金刚石是由原子构成的空间网状结构,为原子晶体;
③NH4Cl晶体是由铵根离子和氯离子构成的,为离子晶体;
④C60 晶体是由分子构成的,为分子晶体;
⑤H2O晶体是由分子构成的,为分子晶体;
⑥Cl2晶体是由分子构成的,为分子晶体;
⑦KNO3 晶体是由钾离子和硝酸根离子构成的,为离子晶体;
⑧SiO2是由原子构成的空间网状结构,为原子晶体;
③NH4Cl ⑦KNO3 中既有离子键和共价键;
故答案为:②⑧;④⑤⑥;①③⑦;③⑦
 ;
;过氧化氢为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为:
 ;
;氧化镁是离子化合物,由镁离子与氧离子构成,氧化镁的电子式为
 ;
;二氧化碳为共价化合物,分子中存在两个碳氧双键,二氧化碳的电子式为:
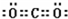
故答案为:
 ;
; ;
; ;
; ;
;(2)①MgCl2晶体是由镁离子和氯离子构成的,为离子晶体;
②金刚石是由原子构成的空间网状结构,为原子晶体;
③NH4Cl晶体是由铵根离子和氯离子构成的,为离子晶体;
④C60 晶体是由分子构成的,为分子晶体;
⑤H2O晶体是由分子构成的,为分子晶体;
⑥Cl2晶体是由分子构成的,为分子晶体;
⑦KNO3 晶体是由钾离子和硝酸根离子构成的,为离子晶体;
⑧SiO2是由原子构成的空间网状结构,为原子晶体;
③NH4Cl ⑦KNO3 中既有离子键和共价键;
故答案为:②⑧;④⑤⑥;①③⑦;③⑦
点评:本题考查了电子式的书写、晶体类型的判断等知识点,要求学生熟练掌握电子式的概念及表示方法,根据晶体的构成微粒确定晶体类型,题目难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
根据下列物质的化学性质,判断其应用错误的是( )
| A、酒精能使蛋白质变性,可用于杀菌消毒 |
| B、CaO能用于燃煤的脱硫 |
| C、明矾水解时产生具有吸附性的胶体粒子,可以除去水中的杂质离子 |
| D、氯气泄露时,人群应向高处疏散 |
对有机物CH3CH=CH-C≡CH结构的描述正确的是( )
| A、分子中所有碳原子在同一直线上 |
| B、分子中所有氢原子一定在同一平面内 |
| C、分子中在同一平面内的原子最多有6个 |
| D、分子中在同一平面内的原子最多有9个 |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、在PH=0的无色溶液中:Na+、Fe3+、I-、SiO32- |
| B、滴入酚酞显红色的溶液中:Na+、S2-、SO32-、AlO2- |
| C、c(Fe2+)=1mo1?L-1的溶液中:H+、Na+、Cl-、NO3- |
| D、加入铝粉能产生大量H2的溶液中:Na+、NO3-、NH4+、HCO3- |


 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题: 目前大量的照明材料或屏幕都使用了发光二极管(LED).市售LED晶片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图.试回答:
目前大量的照明材料或屏幕都使用了发光二极管(LED).市售LED晶片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图.试回答: