题目内容
6.天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4.
已知:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
则CO与H2反应生成CH4(g)和H2O(g)的热化学方程式为CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-203kJ•mol-1.
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入空气,得到单质硫并再生出吸收液,则该反应的化学方程式为2NH4HS+O2$\frac{\underline{\;一定条件下\;}}{\;}$2NH3•H2O+2S↓.
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)?2CO(g)+2H2(g).在密闭
容器中通入物质的量浓度均为0.1mol•L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转
化率与温度及压强的关系如图1所示,则压强P1<P2(填“>”或“<”);压强为P2时,在
Y点:v(正)>v(逆)(填“>”、“<”或“=”);写出X点对应温度下的该反应的平衡常数计算式K=$\frac{0.16{\;}^{2}×0.16{\;}^{2}}{0.02×0.02}$(不必计算出结果).
(4)以二氧化钛表面覆盖CuAl2O4 为催化剂,可以将CH4和CO2直接转化成乙酸.

①在不同温度下催化剂的催化效率与乙酸的
生成速率如图2所示.在275~400℃之间,乙酸的生成速率先降低后升高的原因是275~300℃时催化剂的催化效率降低,化学反应速率降低,300~400℃时温度升高,化学反应速率又加快.
②为了提高该反应中CH4的转化率,可以采取的措施是(写一条)增大反应压强或增大CO2的浓度.
③乙酸(用HAc表示)电离方程式为HAc?H++Ac-,电离常数用Ka表示;乙酸根的水解方程式为Ac-+H2O?OH-+HAc,水解常数用Kh表示,则Kh=$\frac{K{\;}_{w}}{K{\;}_{a}}$(用Ka和水的离子积KW表示).
分析 (1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
根据盖斯定律,②+③-①计算;
(2)根据元素守恒和电子得失守恒写出化学方程式;
(3)该反应正向为体积增大的方向,压强越大,CH4的转化率越小;压强为P2时,在Y点反应未达到平衡,则反应正向移动;X点CH4的平衡转
化率为80%,根据化学平衡常数K=$\frac{c{\;}^{2}(CO)c{\;}^{2}(H{\;}_{2})}{c(CO{\;}_{2})c(CH{\;}_{4})}$结合三组量代入计算;
(4)①由图可知,温度超过275~300℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低;300~400℃时温度升高,化学反应速率加快;
②提高该反应中CH4的转化率,改变条件应使平衡向正反应方向移动,注意不能只增大甲烷的浓度,否则甲烷的转化率降低;
③写出醋酸电离平衡常数、醋酸根离子水解平衡常数,水的离子积常数进行比较,从而得出结论.
解答 解:(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
根据盖斯定律,②+③-①得:CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-73-171+41=-203kJ•mol-1,
故答案为:CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-203kJ•mol-1;
(2)一定条件下向NH4HS溶液中通入空气,得到单质硫并再生出吸收液即氨水,则根据元素守恒及题中的反应物和生成物可知化学方程式为:2NH4HS+O2$\frac{\underline{\;一定条件下\;}}{\;}$2NH3•H2O+2S↓,故答案为:2NH4HS+O2$\frac{\underline{\;一定条件下\;}}{\;}$2NH3•H2O+2S↓;
(3)该反应正向为体积增大的方向,压强越大,CH4的转化率越小,已知相同温度下,P1条件下的转化率大于P2,则P1小于P2;压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)大于v(逆);
X点CH4的平衡转化率为80%,
则 CO2(g)+CH4(g)?2CO(g)+2H2(g),
开始0.1 0.1 0 0
转化0.08 0.08 0.16 0.16
平衡0.02 0.02 0.16 0.16
其平衡常数表达式是K=$\frac{c{\;}^{2}(CO)c{\;}^{2}(H{\;}_{2})}{c(CO{\;}_{2})c(CH{\;}_{4})}$=$\frac{0.16{\;}^{2}×0.16{\;}^{2}}{0.02×0.02}$,
故答案为:<;>;$\frac{0.16{\;}^{2}×0.16{\;}^{2}}{0.02×0.02}$;
(4)①温度超过275~300℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低;300~400℃时温度升高,化学反应速率加快;
,故答案为:275~300℃时催化剂的催化效率降低,化学反应速率降低,300~400℃时温度升高,化学反应速率又加快;
②提高该反应中CH4的转化率,改变条件应使平衡向正反应方向移动,正反应是气体体积减小的反应,缩小容器体积增大压强、增大CO2的浓度,平衡正向移动,反应物转化率增大,故答案为:增大反应压强或增大CO2的浓度;
③电离方程式为HAc?H++Ac-,电离常数用Ka=$\frac{c(Ac{\;}^{-})c(H{\;}^{+})}{c(HAc)}$,乙酸根的水解方程式为Ac-+H2O?OH-+HAc,水解常数用Kh=$\frac{c(HAc)c(OH{\;}^{-})}{c(Ac{\;}^{-})}$,Kw=c(H+).c(OH-),所以Ka•Kh=Kw,则
Kh=$\frac{K{\;}_{w}}{K{\;}_{a}}$,故答案为:$\frac{K{\;}_{w}}{K{\;}_{a}}$.
点评 本题考查了盖斯定律的应用、方程式的书写、化学平衡常数、平衡移动等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.


(1)写出装置A中发生反应的离子方程式:4H++2Cl-+MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O
(2)写出试剂Y的名称:饱和食盐水.
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物.可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究.
①提出合理假设:
假设一:存在两种成分:NaHCO3和NaCl
假设二:存在三种成分:NaHCO3和NaCl、Na2CO3.
②设计方案,进行实验.请写出实验步骤以及预期现象和结论(可不填满).
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴BaCl2溶液 | ①若无明显现象,证明固体中不含碳酸钠;②若溶液变浑浊,证明固体中含有碳酸钠. |
| 步骤3:向B试管中滴加AgNO3溶液和稀硝酸 | 若溶液变浑浊,结合步骤2中的①,则假设一成立;结合步骤2中的②,则假设二成立. |
②若假设二成立:请设计最佳实验方案,测定C中NaHCO3的质量分数$\frac{84({m}_{1}-{m}_{2})}{31{m}_{1}}$×100%.
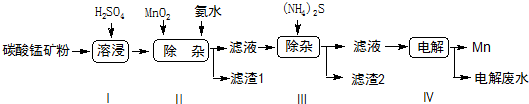
已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,则该反应过程中的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,加氨水调节溶液的pH为5.0-6.0,以除去Fe3+.
(3)步骤Ⅲ中,滤渣2的主要成分是CoS和NiS.
(4)步骤Ⅳ中,在阴(填“阴”或“阳”)极析出Mn,电极反应方程式为Mn2++2e-=Mn.
(5)已知:S(s)+O2(g)=SO2(g)△H=a kJ•mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s)△H=b kJ•mol-1
MnO2(s)+SO2(g)=MnSO4(s)△H=c kJ•mol-1,则Mn的燃烧热△H=-( a+c-b) kJ•mol-1.
(6)按照图示流程,含MnCO3质量分数为57.5%的碳酸锰矿a kg,最终得到Mn的质量为110b kg,忽略中间过程的损耗,则除杂质时,所引入的锰元素相当于MnO2174b-0.435akg.[MnCO3摩尔质量115g/mol,MnO2摩尔质量87g/mol].
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是催化剂、吸水剂;
(2)球形干燥管C的作用是防止倒吸反应结束后D中的现象是溶液分层,上层为无色油状液体
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和少量水,应先加入无水氯化钙,分离出乙醇,然后在混合液中加入沸石(或碎瓷片)再加热进行蒸馏,收集77℃左右的馏分,以得一较纯净的乙酸乙酯.
| A. | 活性炭 | B. | 氯气 | C. | 明矾 | D. | 次氯酸钠 |