题目内容
12.Na2O2、HCl、Al2O3三种物质溶于水中,完全反应后,测得所得溶液中只含有AlO2-、Na+、Cl-(不考虑AlO2-的水解),则Na2O2、HCl、Al2O3的物质的之比( )| A. | 4:6:1 | B. | 8:6:1 | C. | 3:3:1 | D. | 2:2:2 |
分析 所得溶液中只含有AlO2-、Na+、Cl-(不考虑AlO2-的水解),由电荷守恒可知,n(Na+)=n(AlO2-)+n(Cl-),结合原子守恒计算.
解答 解:所得溶液中只含有AlO2-、Na+、Cl-(不考虑AlO2-的水解),
由电荷守恒可知,n(Na+)=n(AlO2-)+n(Cl-),
由原子守恒可知,2n(Na2O2)=2n(Al2O3)+n(HCl),
A.若为4:6:1,则2×4=2×1+6,故A选;
B.若为8:6:1,则2×8≠2×1+6,故B不选;
C.若为3:3:1,则3×2≠2×1+3,故C不选;
D.若为2:2:2,则2×2≠2×2+2,故D不选;
故选A.
点评 本题考查化学反应方程式的计算,为高频考点,把握电荷守恒及原子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
19.已知非金属单质在碱性条件下易发生歧化反应,而其生成物在酸性条件下能够发生归中反应,现将aKOH、bH2O、cKCl、dKClO、eCl2、fKClO3可组成一个氧化还原反应,则下列有关说法错误的是( )
| A. | c、d、f之比可能为16:1:3 | |
| B. | 一定有a=2e,b=e | |
| C. | 若n(KClO):n(KClO3)=1:1,则a、b、c、d、e、f依次为8:4:6:1:4:1 | |
| D. | 若将该方程式拆开写成两个“半反应”,其中一定有Cl2-2e-=2Cl- |
7.某饱和一元醛发生银镜反应可得21.6g银;将等量的该醛完全燃烧,生成3.6g水.此醛可能是( )
| A. | 甲醛 | B. | 乙醛 | C. | 丙醛 | D. | 丁醛 |
4.常温下,将铜片投入到下列溶液中,会产生气体的是( )
| A. | 稀硫酸 | B. | 稀盐酸 | C. | 浓硝酸 | D. | 浓硫酸 |
1.从海水中提取镁时,涉及不到的化学反应是( )
| A. | MgCl2+Ca(OH)2═CaCl2+Mg(OH)2↓ | B. | Mg(OH)2+2HCl═MgCl2+2H2O | ||
| C. | Mg(OH)2+H2SO4═MgSO4+2H2O | D. | MgCl2$\frac{\underline{\;通电\;}}{熔融}$Mg+Cl2↑ |
2.下列离子方程式书写正确的是( )
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 0.01mol/L NH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH- $→_{△}^{NaOH}$ CH2BrCOO-+H2O | |
| D. | 用稀氢氧化钠溶液吸收二氧化氮:2OH-+2NO2=NO3-+NO↑+H2O |
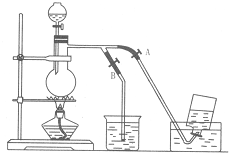 如图表示在没有通风橱收纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹.
如图表示在没有通风橱收纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹.