题目内容
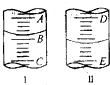
7.实验室用如图I所示的装置制取干燥的氨气.
(1)A处反应的化学方程式为2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+CaCl2.
(2)为收集到干燥的氨气C应接E.(填序号)
(3)为了检验氨气是否集满,可将湿润的红色石蕊试纸靠近试管口,若试纸变蓝或蘸有浓盐酸的玻璃棒,冒白烟,则证明已收集满.
(4)在水槽中加入滴加酚酞的水,将充满氨气的试管管口向下倒拿着放入水槽中(如图Ⅱ),将拇指稍移开试管口,可观察到:图Ⅱ滴加酚酞的水溶液进入试管中,无色溶液变红.
(5)在D、E、F三种气体收集方法中,能用于收集NO的是D.
分析 (1)实验室制备氨气的反应原理是利用固体氯化铵和氢氧化钙固体混合加热反应;
(2)氨气极易溶于水,比空气轻,不能用排水法收集,可以用向下排空气方法收集;
(3)氨气是碱性气体,遇到湿润的红色石蕊试纸变蓝,或与氯化氢反应生成白烟检验是否集满;
(4)氨气极易溶于水,和水反应生成一水合氨在溶液中存在电离平衡,是弱碱遇到酚酞变红色;
(5)一氧化氮是比空气略重的气体,难溶于水,易被空气氧化为二氧化氮,依据一氧化氮性质分析判断气体的收集装置.
解答 解:(1)根据装置A的特征,实验室制备氨气的反应原理是利用固体氯化铵和氢氧化钙固体混合加热反应,反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+CaCl2;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+CaCl2;
(2)氨气极易溶于水,比空气轻,不能用排水法收集,可以用向下排空气方法收集,选择装置E收集;
故答案为:E;
(3)氨气是碱性气体,遇到湿润的红色石蕊试纸变蓝证明集满或蘸有浓盐酸的玻璃棒,冒白烟,
故答案为:湿润的红色石蕊试纸,试纸变蓝或蘸有浓盐酸的玻璃棒,冒白烟;
(4)氨气极易溶于水溶液进入试管中,和水反应生成一水合氨在溶液中存在电离平衡,电离出氢氧根离子溶液呈碱性,弱碱遇到酚酞变红色;
故答案为:溶液进入试管中,无色溶液变红;
(5)一氧化氮是比空气略重的气体,难溶于水,易被空气氧化为二氧化氮,所以用排水方法收集纯净的一氧化氮气体,所以选择D装置;
故答案为:D.
点评 本题考查了实验室制备氨气的原理,氨气的性质分析判断,注意氨气极易溶于水生成的一水合氨是弱碱,题目难度中等.

| A. | 硅可用作半导体材料 | |
| B. | 二氧化硅可用于制造光导纤维 | |
| C. | Fe2O3 俗称铁红,常用作红色油漆和涂料 | |
| D. | 煤是一种清洁能源,直接燃烧不会造成环境污染 |
| A. | 群众向高处转移 | |
| B. | 用沾NaOH溶液的湿毛巾捂住口鼻 | |
| C. | 用高压水枪向空中喷洒含碱性物质的水溶液可解毒 | |
| D. | 用沾Na2CO3溶液的湿毛巾捂住口鼻 |
 草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100mL水溶液.量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol•L-1的KMnO4溶液滴定,所发生的反应:KMnO4+H2C2O4+H2SO4=K2SO4+CO2↑+MnSO4+H2O
草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100mL水溶液.量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol•L-1的KMnO4溶液滴定,所发生的反应:KMnO4+H2C2O4+H2SO4=K2SO4+CO2↑+MnSO4+H2O