题目内容
15.“西气东输”工程已基本完成,浦东和杨浦大多居民已由管道煤气改用天然气,原管道煤气(水煤气)的主要成分是H2和CO,现改用天然气则燃具必增加一个阀门,以增加空气的进量,目的是使天然气充分燃烧.分析 水煤气是由煤和水蒸汽在高温条件下生成的;根据化学方程式中的微观粒子个数比进行分析消耗氧气的多少,由于燃烧同样质量的天然气和一氧化碳,天然气燃烧需要的氧气多,燃烧管道煤气的灶具如需改烧天然气,需要加大氧气的量,据此分析.
解答 解:水煤气是由煤和水蒸汽在高温调价下反应生成的,主要成分为氢气和CO;由化学方程式的微观粒子个数比可知,燃烧相同体积的管道煤气和天然气时,天然气消耗的氧气多,故应调整灶具进气量阀门,即增大空气的进入量,从而能使天然气充分燃烧.
故答案为:H2和CO;空气;使天然气充分燃烧.
点评 本题考查了水煤气的成分、物质燃烧消耗氧气量的判断和处理措施,较简单.注意基础的掌握.

练习册系列答案
相关题目
6.下列有机物中,是l-丙醇在铜的催化作用下氧化产物的同分异构体的是( )
| A. | CH3COCH3 | B. | CH3CH2CHO | C. | CH3CH(OH)CH3 | D. | CH3CH2COOH |
3.下列变化中属于物理变化的是( )
| A. | 煤的干馏 | B. | 风化 | C. | 石油分馏 | D. | 重油裂化 |
10.如图是锌-铜-稀硫酸原电池装置,下列叙述正确的是( )


| A. | 锌是正极,铜是负极,电流的方向是从锌到铜 | |
| B. | 锌片质量减少,铜片质量增加 | |
| C. | 正极和负极上发生的都是氧化还原反应 | |
| D. | 原电池中的能量变化是:化学能转化为电能 |
20.下列化学药品名称与警示标志对应正确的是( )
| A. |  酒精 | B. |  浓硫酸 | C. |  汽油 | D. |  浓硝酸 |
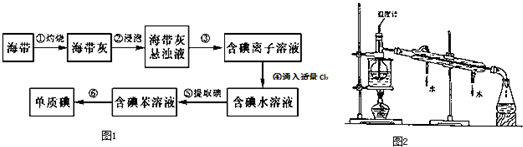
4. “8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.
“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.
探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
(1)NaCN溶液呈碱性的原因是CN-+H2O?HCN+OH- (用离子方程式表示)
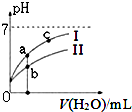
(2)如图表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是CDE
A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(CN-)>c(HCOO-)>c(OH-)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:CN-+CO2+H2O=HCN+CO32-
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.图象中a点酸的总浓度小于b点酸的总浓度
E.图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表HCOOH或HCN)
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为KHCO3.
(4)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-)<c(HCN)(填“>”、“<”或“=”)
探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用下图所示装置进行实验.将CN-的浓度为0,.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴人100mL稀H2SO4,关闭活塞.
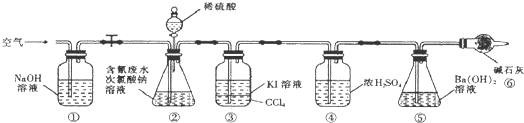
已知装置②中发生的主要反应依次为:CN-+ClO-=CNO-+Cl-2CNO-+2H++3C1O-=N2↑+2CO2↑+3C1-+H2O
(5)①和⑥的作用是吸收空气中二氧化碳排除空气中二氧化碳对实验的干扰.
(6)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置⑤反应前后的质量(从装置①到⑥中选择,填装置序号).
 “8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.
“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数( 25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
(2)如图表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是CDE
A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(CN-)>c(HCOO-)>c(OH-)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:CN-+CO2+H2O=HCN+CO32-
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.图象中a点酸的总浓度小于b点酸的总浓度
E.图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表HCOOH或HCN)
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为KHCO3.
(4)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-)<c(HCN)(填“>”、“<”或“=”)
探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用下图所示装置进行实验.将CN-的浓度为0,.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴人100mL稀H2SO4,关闭活塞.

已知装置②中发生的主要反应依次为:CN-+ClO-=CNO-+Cl-2CNO-+2H++3C1O-=N2↑+2CO2↑+3C1-+H2O
(5)①和⑥的作用是吸收空气中二氧化碳排除空气中二氧化碳对实验的干扰.
(6)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置⑤反应前后的质量(从装置①到⑥中选择,填装置序号).
5.下列化学用语正确的是( )
| A. | 乙醇的官能团是:-OH | B. | 乙醇的分子式是:CH3CH2OH | ||
| C. | 乙烯的结构简式是:CH2CH2 | D. | 乙烯无官能团 |