题目内容
17. 燃料电池是一种很有发展前景的电池,甲醇燃料电池的结构如图.丁烷在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2C4H10+13O2═8CO2+10H2O.下列说法中正确的是( )
燃料电池是一种很有发展前景的电池,甲醇燃料电池的结构如图.丁烷在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2C4H10+13O2═8CO2+10H2O.下列说法中正确的是( )| A. | 右边的电极为电池的负极,b处通入的是空气 | |
| B. | 左边的电极为电池的负极,a处通入的是空气 | |
| C. | 电池负极的反应式为:2C4H10+16H2O-52e-═8CO2+52H+ | |
| D. | 电池的正极反应式为:13O2+26H2O+52e-═4OH- |
分析 A、依据图中电子流向分析,原电池中电子是从负极流向正极;电子流出的一端是负极,流入的一端为正极,得到电子发生还原反应;
B、依据图中电子流向分析,原电池中电子是从负极流向正极;电子流出的一端是负极,失电子发生氧化反应;
C、负极是甲醇失电子发生氧化反应,依据电极反应的产物和环境写出电极反应式;
D、正极是氧气得到电子发生还原反应,氧气得到电子生成氢氧根离子,在图中是酸性介质,电极反应产物应写成水的形式.
解答 解:A、原电池中电子是从负极流向正极;电子流出的一端是负极,流入的一端为正极,所以右边的电极为电池的正极,b处通入的是空气,故A错误;
B、依据图中电子流向分析,原电池中电子是从负极流向正极;电子流出的一端是负极,失电子发生氧化反应;所以a处是失电子的一端,通的是丁烷,故B错误;
C、负极是丁烷失电子发生氧化反应,依据电池反应和酸性环境,2C4H10+13O2═8CO2+10H2O,所以负极电极反应为:2C4H10+16H2O-52e-═8CO2+52H+,故C正确;
D、正极是氧气得到电子发生还原反应,氧气得到电子生成氢氧根离子,在图中是酸性介质,电极反应产物应写成水的形式;电池的正极反应式为:O2+4H++4e-=2H2O,故D错误;
故选C.
点评 本题考查了原电池的原理应用,电极判断,电极名称,电极反应,电极反应式书写的分析判断,掌握原电池原理是解题关键,燃料电池的特征是燃料是电子在负极反应,氧气在正极发生还原反应,题目难度中等.

练习册系列答案
相关题目
7.下列有关除杂质(括号中为杂质)的操作中,错误的是( )
| A. | 溴苯(液溴):加NaOH溶液,充分振荡,分液,留下层液体 | |
| B. | 乙醇(乙醛):加新制Cu(OH)2溶液,加热至沸腾,过滤取溶液即可 | |
| C. | 乙烷(乙烯):通过盛有足量溴水溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,留上层液体 |
8.下列物质的水溶液能导电,但属于非电解质的是( )
| A. | Cl2 | B. | HCl | C. | BaCO3 | D. | SO2 |
5.下列物质中,不属于烷烃的是( )
| A. | CH4 | B. | C3H8 | C. | C10H20 | D. | C5H12 |
12.下列组合中中心离子的电荷数和配位数均相同的是( )
| A. | K[Ag(CN)2]、[Cu(NH3)4]SO4 | B. | [Ag(NH3)2]Cl、K[Ag(CN)2] | ||
| C. | [Ag(NH3)2]Cl、[Cu(NH3)4]SO4 | D. | [Ni(NH3)4]Cl2、[Ag(NH3)2]Cl |
6.下列说法正确的是( )
| A. | SiO2 是酸性氧化物,能与氢氟酸反应 | |
| B. | Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
7.设NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.00mol•L-1NaCl溶液中含有Na+的数目为NA | |
| B. | 常压下常温,6.4g由氧气和臭氧组成的混合物中含有的分子总数为0.2NA | |
| C. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| D. | 7.8g过氧化钠含有的共用电子对数为0.1NA |
 中学化学中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒•夏特列原理.请回答下列问题:
中学化学中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒•夏特列原理.请回答下列问题: 氧化还原反应和离子反应是中学化学中重要的反应类型.回答下列问题:
氧化还原反应和离子反应是中学化学中重要的反应类型.回答下列问题: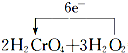 =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O