题目内容
8.NaHSO4是一种酸式盐.(1)NaHSO4晶体熔化时的电离方程式为NaHSO4=Na++HSO4-.
(2)0.1mol•L-1的NaHSO4溶液的pH=1.
(3)NaHSO4溶液与NaHCO3溶液反应的离子方程式为H++HCO3-═H2O+CO2↑.
(4)2mol•L-1NaHSO4与1mol•L-1Ba(OH)2溶液等体积混合,反应的离子方程式为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O.若在反应的溶液中继续滴加Ba(OH)2溶液,反应的离子方程式为SO42-+Ba2+═BaSO4↓.
分析 (1)NaHSO4晶体熔化时电离生成钠离子和硫酸氢根离子;
(2)硫酸氢钠在溶液中电离出氢离子,根据氢离子浓度计算pH;
(3)硫酸氢钠与碳酸氢钠溶液反应生成硫酸钠、二氧化碳气体和水;
(4)2mol•L-1NaHSO4与1mol•L-1Ba(OH)2溶液等体积混合,即NaHSO4与Ba(OH)2按照物质的量2:1反应;反应后溶液中含有过量的硫酸根离子,继续滴加Ba(OH)2溶液,钡离子与硫酸根离子反应生成硫酸钡沉淀.
解答 解:(1)NaHSO4晶体熔化时电离生成钠离子和硫酸氢根离子,电离方程式为NaHSO4=Na++HSO4-,故答案为:NaHSO4=Na++HSO4-;
(2)0.1mol•L-1的NaHSO4溶液完全电离出氢离子,所以氢离子浓度为0.1mol/L,则pH=1,故答案为:1;
(3)NaHSO4和NaHCO3两溶液混合,二者反应生成硫酸钠、二氧化碳气体和水,反应的离子方程式为:H++HCO3-═H2O+CO2↑,
故答案为:H++HCO3-═H2O+CO2↑;
(4)2mol•L-1NaHSO4与1mol•L-1Ba(OH)2溶液等体积混合,即NaHSO4与Ba(OH)2按照物质的量2:1反应,氢离子与氢氧根离子恰好反应,反应的离子方程式:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O;
反应后溶液中存在剩余的硫酸根离子,继续滴加Ba(OH)2溶液,钡离子与硫酸根离子反应生成硫酸钡沉淀,反应的离子方程式为:SO42-+Ba2+═BaSO4↓,
故答案为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O;SO42-+Ba2+═BaSO4↓.
点评 本题考查了离子方程式的书写判断为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案| A. | N2 | B. | NH3 | C. | CO2 | D. | MgCl2 |
| A. | MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 向澄清的石灰水中加入过量NaHCO3溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量氨水溶液:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向Ca(ClO)2溶液中通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
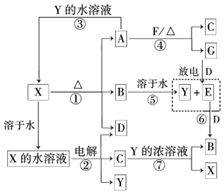 A~G及X、Y均是中学化学常见物质,其中B、D、E、F、G在常温下为气体且B为红棕色,C的硫酸盐溶液通常为蓝色,它们之间有如下转化关系(其中反应③④⑦的产物中的水已略去).
A~G及X、Y均是中学化学常见物质,其中B、D、E、F、G在常温下为气体且B为红棕色,C的硫酸盐溶液通常为蓝色,它们之间有如下转化关系(其中反应③④⑦的产物中的水已略去).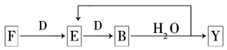
 .
.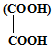
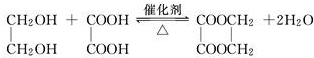 .
.