题目内容
下列化学用语表达正确的是( )
A、氯离子的结构示意图 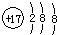 |
| B、HClO中Cl的化合价为:+1 |
| C、氯化钙的化学式:CaCl |
| D、硫酸的电离方程式:H2SO4=H2++SO42- |
考点:原子结构示意图,常见元素的化合价,电离方程式的书写,电子式、化学式或化学符号及名称的综合
专题:
分析:A.氯离子(Cl-)带一个单位负电荷,即得到一个电子形成的;
B.次氯酸中H与Cl分别与O形成1对共价键;
C.氯化钙中Ca元素的化合价为+2价,Cl元素的化合价为-1价;
D.H2+错误.
B.次氯酸中H与Cl分别与O形成1对共价键;
C.氯化钙中Ca元素的化合价为+2价,Cl元素的化合价为-1价;
D.H2+错误.
解答:
解:A.氯原子得1个电子后形成氯离子(Cl-),即最外层电子数由7个变成8个,其它不变,故A正确;
B.次氯酸中H与Cl分别与O形成1对共价键,故O为-2价,H和Cl均为+1价,故B正确;
C.氯化钙中Ca元素的化合价为+2价,Cl元素的化合价为-1价,正确应为:CaCl2,故C错误;
D.物质电离后角标要转化成化学计量数,同时注意离子所带的电荷数,正确的离子方程式为:H2SO4=2H++SO42-,故D错误;故选AB.
B.次氯酸中H与Cl分别与O形成1对共价键,故O为-2价,H和Cl均为+1价,故B正确;
C.氯化钙中Ca元素的化合价为+2价,Cl元素的化合价为-1价,正确应为:CaCl2,故C错误;
D.物质电离后角标要转化成化学计量数,同时注意离子所带的电荷数,正确的离子方程式为:H2SO4=2H++SO42-,故D错误;故选AB.
点评:本题考查化学用语,电离等,难度不大,注意电离方程式要遵循电荷守恒.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在无色透明溶液中,下列各离子组能大量共存的是( )
| A、SO42- Na+Fe3+ Cl- |
| B、Ba2+ Na+Cl- SO42- |
| C、HCO3-K+ SO42-OH- |
| D、Ag+ Al3+ NO3-H+ |
下列离子方程式书写正确的是( )
| A、实验室用大理石和稀盐酸制取二氧化碳:2H++CO32-=CO2↑+H2O |
| B、氯气与碘化钾溶液的反应:Cl2+2 I-=2Cl-+I2 |
| C、向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
| D、三氯化铁溶液中加入铜粉:Fe3++Cu═Fe+Cu 2+ |
纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液.放电时两个电极反应分别为:Zn+2OH-→Zn(OH)2+2e-Ag2O+H2O+2e-→2Ag+2OH-,下列说法正确的是( )
| A、锌是负极,氧化银是正极 |
| B、锌发生还原方应,氧化银发生氧化反应 |
| C、溶液中OH-向正极移动,K+、H+向负极移动 |
| D、在电池放电过程中,电解质溶液的酸碱性基本保持不变 |
向13.6gCu和Cu2O的混合物中加入某浓度的稀硝酸0.25L,固体物质完全反应,生成NO和Cu(NO3)2.在所得溶液中加入0.5mol/L的NaOH溶液1L,反应后溶液恰好呈中性,金属离子已完全沉淀,沉淀质量为19.6g,下列说法不正确的是( )
| A、Cu与Cu2O的物质的量之比为2:1 |
| B、硝酸的物质的量浓度为2 mol/L |
| C、Cu、Cu2O与硝酸反应后剩余HNO3的物质的量为0.5mol |
| D、产生的NO在标准状况下的体积为2.24L |
 元素周期表中,金属和非金属分界线附近的元素性质特殊,其单质及化合物应用广泛,成为科学研究的热点.
元素周期表中,金属和非金属分界线附近的元素性质特殊,其单质及化合物应用广泛,成为科学研究的热点.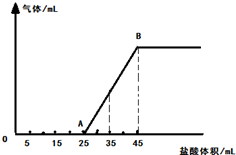 将一定量的NaOH、NaHCO3和Na2CO3三种溶液混合,向混合液中逐渐滴滴加一定浓度的稀盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如图所示:
将一定量的NaOH、NaHCO3和Na2CO3三种溶液混合,向混合液中逐渐滴滴加一定浓度的稀盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如图所示: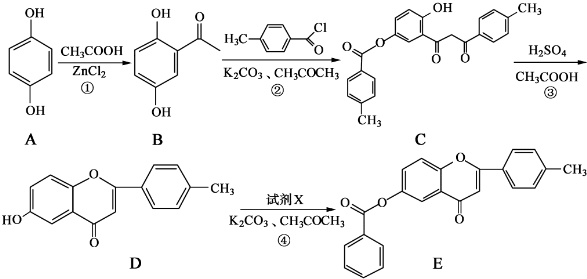

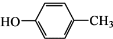 和CH3COOH为原料制备
和CH3COOH为原料制备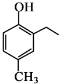 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: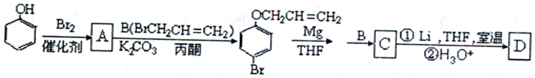
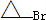 是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有
是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有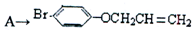 的有机反应类型
的有机反应类型