题目内容
元素周期表第二周期Li到Ne原子的电离能总的趋势是怎样变化的
[ ]
A.从大变小
B.从小变大
C.从Li到N逐渐增加,从N到Ne逐渐下降
D.没有多大变化
B.从小变大
C.从Li到N逐渐增加,从N到Ne逐渐下降
D.没有多大变化
B

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
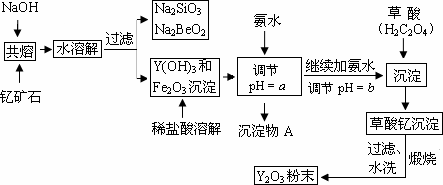
稀土元素是周期表中IIIB族钪、钇和锏系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3.其中钇(Y)元素是激光和超导的重要材料.我国蕴藏丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
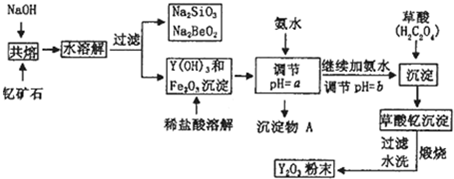
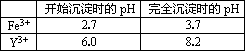
已知:①常温下KSP=[Fe(OH)3]=4×10-38,lg2≈0.3 ②有关金属离子形成氢氧化物沉淀时的pH如下表:
③在周期表中、铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似.
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为 .
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀.则
①最好选用盐酸、 (填字母)两种试剂,再通过必要的操作即可实现.
a.NaOH溶液b.氨水c.CO2气d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式: .
(3)一般认为离子浓度小于1×10-5mol?L-1为沉淀完全,试计算Fe3+完全沉淀时x= ,实际操作要大于x,为使Fe3+沉淀完全,须用氨水调节pH=a,则a应控制在 的范围内;检验Fe3+是否沉淀完全的操作方法是 .

已知:①常温下KSP=[Fe(OH)3]=4×10-38,lg2≈0.3 ②有关金属离子形成氢氧化物沉淀时的pH如下表:
| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | x |
| Y3+ | 6.0 | 8.2 |
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀.则
①最好选用盐酸、
a.NaOH溶液b.氨水c.CO2气d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:
(3)一般认为离子浓度小于1×10-5mol?L-1为沉淀完全,试计算Fe3+完全沉淀时x=

 HCN+OH-
HCN+OH-