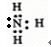题目内容
X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,M是生活中最常用的金属,它与L可以形成三种化合物.
请回答下列问题:
(1)Y在元素周期表中的位置为
(2)硒(se)是人体必需的微量元素,与L同一主族,该族2~5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1mol硒化氢反应热的是
a.+99.7mol?L-1 b.+29.7mol?L-1 c.-20.6mol?L-1 d.-241.8kJ?mol-1
(3)已知(YZ)2分子所有的原子都满足8电子,请写出其结构式
(4)L、X两元素按原子数目比l:1和1:2形成分子A和B.
①用电子式表示B的形成过程
 .
.
②M在高温下可以与B反应,写出该反应的化学方程式
某同学将反应得到的黑色粉末全部溶于足量的硫酸溶液中,发现有少量的气泡产生,溶液呈棕黄色,该同学判断溶液中一定同时存在两种M的金属阳离子.请你选择合适的试剂与合理的步骤证明该同学的推断
③若该同学将上述棕黄色溶液1mL加入到2mL A的浓溶液中,预计会看到的实验现象是
请回答下列问题:
(1)Y在元素周期表中的位置为
第二周期,第ⅣA族
第二周期,第ⅣA族
.(2)硒(se)是人体必需的微量元素,与L同一主族,该族2~5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1mol硒化氢反应热的是
b
b
(填字母代号).a.+99.7mol?L-1 b.+29.7mol?L-1 c.-20.6mol?L-1 d.-241.8kJ?mol-1
(3)已知(YZ)2分子所有的原子都满足8电子,请写出其结构式
N≡C-C≡N
N≡C-C≡N
;(YZ)2可以与X2化合生成XYZ,其水溶液是一种酸,某浓度该酸的钾盐(KYZ)溶液能使酚酞溶液显红色,请用离子方程式表示原因CN-+H2O HCN+OH-
HCN+OH-
 HCN+OH-
HCN+OH-CN-+H2O HCN+OH-
HCN+OH-
. HCN+OH-
HCN+OH-(4)L、X两元素按原子数目比l:1和1:2形成分子A和B.
①用电子式表示B的形成过程


②M在高温下可以与B反应,写出该反应的化学方程式
3Fe+4H2O
Fe3O4+4H2↑
| ||
3Fe+4H2O
Fe3O4+4H2↑
.
| ||
某同学将反应得到的黑色粉末全部溶于足量的硫酸溶液中,发现有少量的气泡产生,溶液呈棕黄色,该同学判断溶液中一定同时存在两种M的金属阳离子.请你选择合适的试剂与合理的步骤证明该同学的推断
取溶液少许,滴加KSCN溶液,溶液变红色,证明有Fe3+,另取溶液少许,加入KMnO4酸性溶液,紫色褪去,证明有Fe2+.
取溶液少许,滴加KSCN溶液,溶液变红色,证明有Fe3+,另取溶液少许,加入KMnO4酸性溶液,紫色褪去,证明有Fe2+.
.③若该同学将上述棕黄色溶液1mL加入到2mL A的浓溶液中,预计会看到的实验现象是
有大量气泡出现
有大量气泡出现
.分析:X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,则X为氢、Y为碳、Z为氮、L为氧;M是生活中最常用的金属,它与L可以形成三种化合物,则铁与氧元素可形成氧化亚铁、氧化铁、四氧化三铁,即M为铁;
(1)根据碳的质子数及电子排布来分析其在元素周期表的位置;
(2)根据非金属性越强,与氢气化合放出的热量越多来分析;
(3)根据碳、氮的最外层电子数及分子所有的原子都满足8电子来分析结构,并利用盐类的水解来分析使酚酞溶液显红色;
(4)①根据氢、氧元素形成的化合物B为水,由最外层电子来分析化合物的形成过程;
②铁与水蒸气反应生成四氧化三铁和氢气,利用KSCN溶液来检验铁离子,利用亚铁离子的还原性来检验亚铁离子;
③铁离子对过氧化氢的分解起催化作用.
(1)根据碳的质子数及电子排布来分析其在元素周期表的位置;
(2)根据非金属性越强,与氢气化合放出的热量越多来分析;
(3)根据碳、氮的最外层电子数及分子所有的原子都满足8电子来分析结构,并利用盐类的水解来分析使酚酞溶液显红色;
(4)①根据氢、氧元素形成的化合物B为水,由最外层电子来分析化合物的形成过程;
②铁与水蒸气反应生成四氧化三铁和氢气,利用KSCN溶液来检验铁离子,利用亚铁离子的还原性来检验亚铁离子;
③铁离子对过氧化氢的分解起催化作用.
解答:解:X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,则X为氢、Y为碳、Z为氮、L为氧;M是生活中最常用的金属,它与L可以形成三种化合物,则铁与氧元素可形成氧化亚铁、氧化铁、四氧化三铁,即M为铁;
(1)Y为碳,其质子数为6,电子排布中共有2个电子层,最外层电子数为4,则在周期表中第二周期,第ⅣA族,故答案为:第二周期,第ⅣA族;
(2)因该族2~5周期元素非金属性O>S>Se>Te,非金属性越强,与氢气化合放出的热量越多,显然生成1mol硒化氢反应热为b,故答案为:b;
(3)因N原子最外层5个电子,C原子最外层4个电子,为满足(CN)2分子所有的原子都满足8电子结构,其结构式为N≡C-C≡N,KCN溶液能使酚酞溶液显红色,是因CN-水解生成氢氧根离子使溶液显碱性,水解离子方程式为CN-+H2O HCN+OH-,故答案为:N≡C-C≡N;CN-+H2O
HCN+OH-,故答案为:N≡C-C≡N;CN-+H2O HCN+OH-;
HCN+OH-;
(4)①因B为水,氢原子最外层1个电子,氧原子最外层6个电子,则1个氧原子结合2个氢原子,其形成过程为 ,
,
故答案为: ;
;
②由铁与水蒸气反应生成四氧化三铁和氢气,该反应为3Fe+4H2O
Fe3O4+4H2↑,四氧化三铁与硫酸反应后溶液中一定同时存在两种M的金属阳离子为铁离子和亚铁离子,则取溶液少许,滴加KSCN溶液,溶液变红色,证明有Fe3+,另取溶液少许,加入KMnO4酸性溶液,紫色褪去,证明有Fe2+,
故答案为:3Fe+4H2O
Fe3O4+4H2↑;取溶液少许,滴加KSCN溶液,溶液变红色,证明有Fe3+,另取溶液少许,加入KMnO4酸性溶液,紫色褪去,证明有Fe2+;
③A为过氧化氢,在铁离子的催化作用下分解生成氧气,则会观察到有大量气泡出现,故答案为:有大量气泡出现.
(1)Y为碳,其质子数为6,电子排布中共有2个电子层,最外层电子数为4,则在周期表中第二周期,第ⅣA族,故答案为:第二周期,第ⅣA族;
(2)因该族2~5周期元素非金属性O>S>Se>Te,非金属性越强,与氢气化合放出的热量越多,显然生成1mol硒化氢反应热为b,故答案为:b;
(3)因N原子最外层5个电子,C原子最外层4个电子,为满足(CN)2分子所有的原子都满足8电子结构,其结构式为N≡C-C≡N,KCN溶液能使酚酞溶液显红色,是因CN-水解生成氢氧根离子使溶液显碱性,水解离子方程式为CN-+H2O
 HCN+OH-,故答案为:N≡C-C≡N;CN-+H2O
HCN+OH-,故答案为:N≡C-C≡N;CN-+H2O HCN+OH-;
HCN+OH-;(4)①因B为水,氢原子最外层1个电子,氧原子最外层6个电子,则1个氧原子结合2个氢原子,其形成过程为
 ,
,故答案为:
 ;
;②由铁与水蒸气反应生成四氧化三铁和氢气,该反应为3Fe+4H2O
| ||
故答案为:3Fe+4H2O
| ||
③A为过氧化氢,在铁离子的催化作用下分解生成氧气,则会观察到有大量气泡出现,故答案为:有大量气泡出现.
点评:本题考查学生利用原子的性质来推断元素,然后利用原子的最外层电子数来分析位置、物质的结构、化合物的形成过程等,并利用物质的性质或离子的性质来分析解答,综合性较强,难度较大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目