题目内容
6.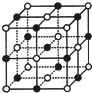 已知NiXO晶体晶胞结构为NaCl型(如图),由于晶体缺陷,x值小于1.测知NiXO晶体x=0.88,晶胞边长为4.28×10-10m 求:(已知:$\sqrt{2}$=1.4)
已知NiXO晶体晶胞结构为NaCl型(如图),由于晶体缺陷,x值小于1.测知NiXO晶体x=0.88,晶胞边长为4.28×10-10m 求:(已知:$\sqrt{2}$=1.4)(1)晶胞中两个Ni原子之间的最短距离3.03×10-10m(精确至0.01).
(2)与O2-距离最近且等距离的Ni离子围成的几何体形状正八面体
(3)晶体中的Ni分别为Ni2﹢、Ni3﹢,求此晶体的化学式Ni0.64Ni0.24O.
(4)已知,NiO晶体熔点大于NaCl,主要原因是Ni2+、O2-电荷多,晶格能大.
分析 (1)由于NiXO晶体晶胞结构为NaCl型,所以晶胞中两个Ni原子之间的最短距离为晶胞面对角线的$\frac{1}{2}$;
(2)采用沿X、Y、Z三轴切割的方法确定O2-的配位数,将Ni离子连接后观察所围成的空间几何构型;
(3)根据NiXO中化合价代数和为零可求得晶体中Ni2﹢与Ni3﹢的最简整数比,然后确定分子式;
(4)离子化合物中离子所带电荷越多,晶格能越大,熔沸点越高.
解答 解:(1)由于NiXO晶体晶胞结构为NaCl型,所以晶胞中两个Ni原子之间的最短距离为晶胞面对角线的$\frac{1}{2}$,由晶胞棱边长可求得晶胞面对角线为长为:$\sqrt{2}$×4.28×10-10m,所以$\frac{1}{2}$×4.28×10-10m=3.03×10-10m;
故答案为:3.03×10-10m;
(2)沿X、Y、Z三轴切割的方法知,X轴上有2个Ni离子,Y轴上有2个Ni离子,Z轴上有2个Ni离子,所以O2-的配位数是6,将6个Ni离子连接后所围成的空间几何构型正八面体;
故答案为:正八面体;
(3)设晶体中Ni2﹢与Ni3﹢的最简整数比为x:y,根据NiXO中化合价代数和为零可知$\frac{2x+3y}{x+y}$×0.88=2,由此解得x:y=8:3,此晶体的化学式:Ni0.64Ni0.24O;
故答案为:Ni0.64Ni0.24O;
(4)Ni2+、O2-电荷多,晶格能越大,熔沸点越高,所以NiO晶体熔点大于NaCl;
故答案为:Ni2+、O2-电荷多,晶格能大.
点评 本题考查物质结构和性质,涉及晶胞计算、晶格能、微粒空间构型判断等知识点,中等难度,注重基础知识的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.一位科学家利用Zn 与某浓度的盐酸反应研究影响化学反应速率的因素,他得到的实验数据如下:
利用上述数据,完成下列问题:
(1)画出时间对温度的曲线图.
(2)利用所画的曲线图和上述实验数据,得出关于温度影响反应速率的什么结论?
(3)对比数据B与F,解释F溶于酸那么快的原因.
| Zn的质量/g | Zn的形状 | 温度/℃ | 溶于酸的时间/s | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 45 | 25 |
| E | 2 | 薄片 | 45 | 25 |
| F | 2 | 薄片 | 15 | 5 |
(1)画出时间对温度的曲线图.
(2)利用所画的曲线图和上述实验数据,得出关于温度影响反应速率的什么结论?
(3)对比数据B与F,解释F溶于酸那么快的原因.
8.在100mL 1mol/L的纯碱溶液中,不断搅拌并逐滴加入12mL 5mol/L 盐酸完全反应后在标准状况下生成二氧化碳的体积为( )
| A. | 13.4 mL | B. | 22.40 mL | C. | 6.72 mL | D. | 0 mL |
11.下列物质对应的电子式书写正确的是( )
| A. |  | B. |  | ||
| C. | N2:N??N | D. | Na2O2: |
15.锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]3d104s24p2,有2个未成对电子.
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键.从原子结构角度分析,原因是Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键.
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因GeCl4、GeBr4、GeI4的熔、沸点依次增高.原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强.
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂.Zn、Ge、O电负性由大至小的顺序是O>Ge>Zn.
(5)①Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为sp3,微粒之间存在的作用力是共价键.
②已知Ge单晶的晶胞的边长为565.76pm,其密度为$\frac{8×73}{6.02×1{0}^{23}×(565.76×1{0}^{-10})^{3}}$g•cm-3(列出计算式即可,阿伏加德罗常数用NA表示,Ge的相对原子质量为73).
(1)基态Ge原子的核外电子排布式为[Ar]3d104s24p2,有2个未成对电子.
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键.从原子结构角度分析,原因是Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键.
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因GeCl4、GeBr4、GeI4的熔、沸点依次增高.原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强.
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(5)①Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为sp3,微粒之间存在的作用力是共价键.
②已知Ge单晶的晶胞的边长为565.76pm,其密度为$\frac{8×73}{6.02×1{0}^{23}×(565.76×1{0}^{-10})^{3}}$g•cm-3(列出计算式即可,阿伏加德罗常数用NA表示,Ge的相对原子质量为73).
16.分子式为C4H8的各种同分异构体共有( )种.
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
 和
和